题目内容
4.下列各组物质之间不可能实现如图所示转化的是 ( )
| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、O2$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO
B、HNO3$\stackrel{少量Fe}{→}$Fe(NO3)3$\stackrel{过量Fe}{→}$Fe(NO3)2;
C.NaOH$\stackrel{过量CO_{2}}{→}$NaHCO3;NaHCO3和CO2不能反应生成碳酸钠;
D.NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2;
解答 解:A、O2$\stackrel{C}{→}$CO2$\stackrel{C}{→}$CO,C+O2=CO2,CO2+C=2CO,可以实现上述转化,故A不符合;
B、HNO3$\stackrel{少量Fe}{→}$Fe(NO3)3$\stackrel{过量Fe}{→}$Fe(NO3)2,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+2Fe(NO3)3=3Fe(NO3)2,可以实现上述转化,故B不符合;
C.NaOH$\stackrel{过量CO_{2}}{→}$NaHCO3;NaHCO3和CO2不能反应生成碳酸钠,不能实现上述转化,故C符合;
D.NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,可以实现上述转化,故D不符合;
故选C.
点评 本题考查无机物的推断,注意转化中发生的化学反应是解答本题的关键,硝酸的强氧化性、氨气的催化氧化、和量不同产物不同的判断为解答的易错点,题目难度中等.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
14.下列有关物质的保存方法中,不正确的是( )
| A. | 过氧化钠固体因易接触到空气中H2O和CO2而变质,所以要密封保存 | |
| B. | 少量金属钠保存在煤油中,大量金属钠用石蜡密封保存 | |
| C. | 硝酸银、新制的饱和氯水保存在棕色细口瓶,并放在阴凉处 | |
| D. | 84消毒液一般可敞口在空气中长久存放 |
12.下列说法正确的是( )
| A. | SO2属于酸性氧化物,CaO属于碱性氧化物 | |
| B. | 盐酸,硝酸都属于无氧酸 | |
| C. | 氢氧化钠,氢氧化铁都是可溶性碱 | |
| D. | CO,CO2都是酸性氧化物 |
9.下列各组中的两稀溶液间的反应,可以用同一个离子方程式来表示的是( )
| A. | HCl与Na2CO3;HNO3与KHCO3 | B. | BaCl2与Na2SO4;Ba(OH)2与CuSO4 | ||
| C. | HCl与KOH;H2SO4与Ba(OH)2 | D. | H2SO4与NaHCO3;NaHSO4与KHCO3 |
16.有NH4HCO3和Na2CO3的混合溶液100mL,将它均分成两份,一份滴加0.1mol/L NaOH溶液200mL恰好反应完全,另一份滴加0.2mol/L H2SO4溶液150mL恰好反应完全,据此得知原混合溶液中c(Na+)为( )
| A. | 2.5 mol/L | B. | 5 mol/L | C. | 1 mol/L | D. | 3 mol/L |
6. (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
①在有催化剂作用下,CH3OH与O2反应主要生成HCHO(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=-470KJ•mol-1.
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:AgCl+2NH3•H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-.
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H<0CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
则0~15min,用H2表示的平均反应速率为0.02 mol•( L•min)-1,达到平衡时CO的转化率为45%.
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
根据上表判断NaHSO3溶液显酸性性.
②在NaHSO3溶液中离子浓度关系正确的是ac (填字母).
a.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
b.c(Na+)=2c(SO32-)+c(HSO3-)
c.c(H2SO3)+c(H+)=c(SO32-)+(OH-)
d.c( Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].①在有催化剂作用下,CH3OH与O2反应主要生成HCHO(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=-470KJ•mol-1.
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:AgCl+2NH3•H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-.
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H<0CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②在NaHSO3溶液中离子浓度关系正确的是ac (填字母).
a.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
b.c(Na+)=2c(SO32-)+c(HSO3-)
c.c(H2SO3)+c(H+)=c(SO32-)+(OH-)
d.c( Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
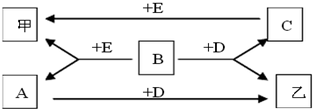 已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.
已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.