题目内容
18.尿素[CO(NH2)2]是首个由无机物人工合成的有机物.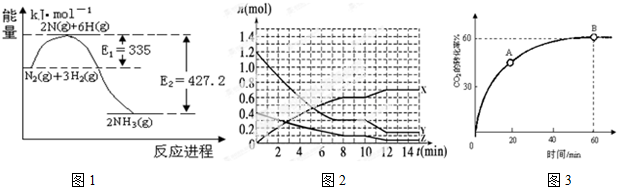
(1)工业上,尿素可以由CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O.
(2)图1所示是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图,请写出工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(3)在一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)═2NH3(g),反应过程如图2所示:
①在0~8min,H2的平均反应速率v(H2)=$\frac{9}{800}$mol/(L.min).
②在该条件下,合成氨的化学平衡常数K=1.33×104.
③在10~12min,通过降低温度使合成氨的化学平衡向正反应(填“正反应”、“逆反应”、“不移动”)方向移动.
(4)当氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=4,CO2的转化率随时间的变化关系如图3所示:A点的逆反应速率v逆(CO2)小于B点的正反应速率v正(CO2)(填“大于”、“小于”或“等于”).此时NH3的平衡转化率为30%.
分析 (1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,配平书写方程式;
(2)由图可知,生成2molNH3(g)放出热量为(427.2-335)kJ=92.2kJ,注明物质的聚集状态与焓变书写热化学方程式;
(3)8min到达平衡,X、Y、Z的浓度变化量之比为0.6:0.9:0.3=2:3:1,故X为氨气、Y为氢气、Z为氮气.
①根据v=$\frac{△c}{△t}$计算v(H2);
②平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
③在10min改变条件瞬间各组分物质的量不变,而氮气、氢气物质的量减小,氨气物质的量增大,平衡向正反应进行,2min到达新平衡又生成0.1mol氨气,小于原平衡中8min内生成的0.6mol氨气,改变条件后反应速率减慢,正反应为气体体积减小放热反应,应该是降低温度;
(4)由CO2的转化率随时间变化图,可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,而B点处于平衡状态;
设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为0.6a,根据方程式计算转化的NH3的物质的量,再根据转化率定义计算.
解答 解:(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O,
故答案为:2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O;
(2)由图可知,生成2molNH3(g)放出热量为(427.2-335)kJ=92.2kJ,反应热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1;
(3)8min到达平衡,X、Y、Z的浓度变化量之比为0.6:0.9:0.3=2:3:1,故X为氨气、Y为氢气、Z为氮气.
①在0~8min内,v(H2)=$\frac{\frac{1.2mol-0.3mol}{10L}}{8min}$=$\frac{9}{800}$mol/(L.min),故答案为:$\frac{9}{800}$mol/(L.min);
②平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(\frac{0.6}{10})^{2}}{\frac{0.1}{10}×(\frac{0.3}{10})^{3}}$=1.33×104,故答案为:1.33×104;
③在10min改变条件瞬间各组分物质的量不变,而氮气、氢气物质的量减小,氨气物质的量增大,平衡向正反应进行,2min到达新平衡又生成0.1mol氨气,小于原平衡中8min内生成的0.6mol氨气,改变条件后反应速率减慢,正反应为气体体积减小放热反应,应该是降低温度,故答案为:降低温度;正反应;
(4)由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,而B点处于平衡状态,故A点v逆(CO2)小于B点v正(CO2),
设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为$\frac{1.2a}{4a}$×100%=30%,
故答案为:小于;30%.
点评 本题考查化学平衡的计算与影响因素、热化学方程式书写,难度中等,较好的考查学生分析解决问题能力.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 2.5 mol/L | B. | 5 mol/L | C. | 1 mol/L | D. | 3 mol/L |
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].①在有催化剂作用下,CH3OH与O2反应主要生成HCHO(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=-470KJ•mol-1.
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:AgCl+2NH3•H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-.
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H<0CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②在NaHSO3溶液中离子浓度关系正确的是ac (填字母).
a.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
b.c(Na+)=2c(SO32-)+c(HSO3-)
c.c(H2SO3)+c(H+)=c(SO32-)+(OH-)
d.c( Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜丝导热性良好,会对中和热的计算造成影响.
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.5℃ | |
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响.
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | 增大Y的物质的量,X的转化率增大 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
| A. | 标准状况下,5.6L SO3含有的分子数为0.25NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: .
.