题目内容
4.将Na2CO3•5H2O与NaHCO3组成的混合物28g放入坩埚中充分加热至固体质量不变时,将残留固体加入200ml某浓度的盐酸中恰好完全反应,可产生标准状况下的气体3.36L,若将原28g混合物加入足量该浓度的盐酸中,完全反应后产生气体8.8g,求:(1)混合物中NaHCO3的质量;
(2)盐酸的物质的量浓度.
分析 (1)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+5H2O,残留固体为碳酸钠,与盐酸反应生成二氧化碳,两过程中二氧化碳物质的量之差为碳酸氢钠分解生成的二氧化碳,结合方程式计算碳酸氢钠的物质的量,再根据m=nM计算其质量;
(2)残留固体为碳酸钠,与盐酸恰好反应生成二氧化碳,根据碳元素守恒计算n残留(Na2CO3),再根据氯离子、钠离子守恒可知:n(HCl)=n(NaCl)=2n残留(Na2CO3),再根据c=$\frac{n}{V}$计算盐酸物质的量浓度.
解答 解:(1)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+5H2O,残留固体为碳酸钠,与盐酸反应生成二氧化碳,两过程中二氧化碳物质的量之差为碳酸氢钠分解生成的二氧化碳,故碳酸氢钠分解生成二氧化碳的物质的量为$\frac{8.8g}{44g/mol}$-$\frac{3.36L}{22.4L/mol}$=0.05mol,结合方程式可知碳酸氢钠的物质的量为0.05mol×2=0.1mol,故NaHCO3的质量为0.1mol×84g/mol=8.4g,
答:混合物中碳酸氢钠的质量为8.4g;
(2)残留固体为碳酸钠,与盐酸恰好反应生成二氧化碳,根据碳元素守恒n残留(Na2CO3)=n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,根据氯离子、钠离子守恒可知:n(HCl)=n(NaCl)=2n残留(Na2CO3)=0.3mol,则盐酸物质的量浓度为$\frac{0.3mol}{0.2L}$=1.5mol/L,
答:盐酸物质的量浓度为1.5mol/L.
点评 本题考查混合物的计算,明确发生的反应即可解答,注意利用守恒思想进行解答,难度中等.

| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 离子还原性:Y2-<Z- | B. | 离子半径W+>Z- | ||
| C. | 气态氢化物稳定性:RH4<XH4 | D. | 酸性:H2YO4<HZO4 |
| A. | 1 mol H2O的质量为18g | |
| B. | 摩尔是表示物质微粒数目的一个物理量 | |
| C. | 3.01×1023个SO2分子的质量为64g | |
| D. | 标准状况下,1 mol任何物质体积均约为22.4L |
| A. | CuO Cu(OH)2 | B. | CuSO4 Cu | C. | CaCO3 CaO | D. | MgSO4 MgCl2 |
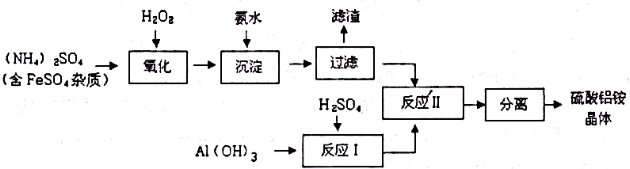
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: