题目内容
14. 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓硫酸中溶质物质的量浓度为18.4mol/L.
(2)取用该浓硫酸时,下列物理量中随所取体积的多少而变化的是AD.
A.溶液中H2SO4的物质的量 B.硫酸物质的量浓度
C.溶液的密度 D.溶液中H2SO4分子数
(3)某学生欲用上述浓硫酸和蒸馏水配制420mL、2mol/L硫酸溶液.
①经计算,需要用量筒量取浓硫酸的体积为54.3mL;若将该浓硫酸与等体积的水充分混合,所得溶液中溶质的质量分数> 49% ( 填“>”、“<”或“=”).
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)CBGFAED;
A.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
B.用量筒量取所需浓硫酸的体积,慢慢沿杯壁注入盛有约200mL水的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.向容量瓶中加入适量水,塞上瓶塞,检查容量瓶是否漏水
D.将容量瓶瓶塞塞上,一只手的食指按住瓶塞,另一只手托住瓶底,反复颠倒摇匀
E.改用胶头滴管加水,平视刻度线使溶液凹面的最低点恰好与刻度线相切
F.用适量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
G.将已冷却的硫酸溶液沿玻璃棒注入一定容积的容量瓶中
③下列实验操作使所配制溶液中硫酸物质的量浓度偏高的是BC.
A.定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
B.将溶液注入容量瓶前没有冷却到室温进行定容
C.用量筒量取浓硫酸时仰视观察凹液面
D.稀释用的烧杯和玻璃棒未洗涤
E.定容时俯视观察容量瓶的凹液面
(4)取上述配制的硫酸溶液200mL与300mL 4.5mol/LCuSO4溶液混合,所得溶液中SO42-的物质的量浓度是3.5mol/L( 混合后溶液体积变化忽略不计 ).
分析 (1)该溶液物质的量浓度=$\frac{1000ρω%}{M}$;
(2)溶液密度、物质的量浓度与溶液体积无关,溶液中溶质物质的量、微粒数都与体积有关;
(3)①依据稀释前后溶液中所含溶质的物质的量不变计算所需浓硫酸的体积;由于硫酸的密度比水的大,则等体积混合时,硫酸溶液的质量大于水的质量,据此分析;
②根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
③根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)混合溶液中c(SO42-)=$\frac{n({H}_{2}S{O}_{4})+n(Cu{SO}_{4})}{V(混合溶液)}$.
解答 解:(1)该溶液物质的量浓度=$\frac{1000ρω%}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)A.根据n=cV知,溶质的物质的量与溶液体积有关,故A选;
B.溶液是均一稳定的,物质的量浓度与溶液体积无关,故B不选;
C.溶液是均一稳定的,溶液的密度与溶液体积无关,故C不选;
D.根据N=CVNA可知,溶液中H2SO4分子数与溶液体积有关,故D选;
故选AD;
(3)①由于实验室无420mL容量瓶,故应选择500mL容量瓶,配制出500mL溶液,设需要浓硫酸体积V,稀释前后溶液中所含溶质的物质的量不变,所以18.4mol/L×V=02.0mol•L-1×500mL,解得V=54.3ml;由于硫酸的密度比水的大,则等体积混合时,硫酸溶液的质量大于水的质量,故将此硫酸与等体积的水混合时,稀释后硫酸的质量分数大于49%.
故答案为:54.3;>;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序为:CBGFAED,故答案为:CBGFAED;
E、定容时,先直接向容量瓶中注水至液面离刻度线1-2cm,后改用胶头滴管逐滴加入至凹液面与刻度线相切,故答案为:胶头滴管;
③A.摇匀后静置,发现液面低于刻线是正常的,若继续加水至与刻线相切则会导致浓度偏低,故A错误;
B.溶液没有恢复到室温就进行定容,则冷却后溶液体积偏小,浓度偏高,故B正确;
C.量取浓硫酸时仰视读数,会导致所量取的浓硫酸的体积偏答,则所配制出的稀硫酸的浓度偏高,故C正确;
D.稀释用的烧杯和玻璃棒未洗涤,会导致溶质的损失,则浓度偏低,故D错误;
E.定容时仰视读数,则会导致溶液体积偏大,则浓度偏小,故E错误.
故选B;
(4)混合溶液中c(SO42-)=$\frac{n({H}_{2}S{O}_{4})+n(Cu{SO}_{4})}{V(混合溶液)}$=$\frac{2mol/L×0.2L+4.5mol/L×0.3L}{0.5L}$=3.5mol/L,故答案为:3.5.
点评 本题考查一定物质的量浓度溶液配制,侧重考查学生实验操作能力及计算能力,明确操作步骤、误差分析、物质的量浓度计算方法即可解答,易错点是误差分析.

(1)工业制硫酸过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
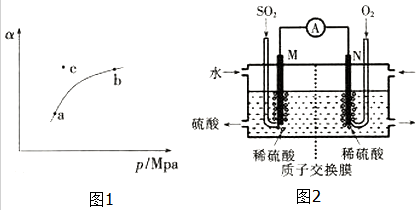
①a、b两点对应的平衡常数K(a)=K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)>c(b).
②c点时,反应速率v(正)<v(逆).
(2)电化学法处理SO2.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(已知:1个e-所带电量为1.6×10-19C).
(3)溶液法处理SO2.
已知常温下H2SO3和H2CO3的电离常数如表所示:
| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| A. | 大于52% | B. | 等于52% | C. | 小于52% | D. | 不能确定 |
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
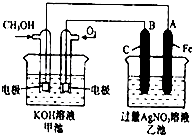 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白: