题目内容
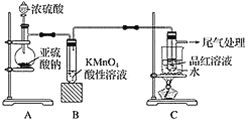
【题目】某研究小组用如图所示装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。请回答下列问题:
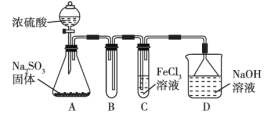
(1)通入足量SO2时C中观察到的现象为______。
(2)根据以上现象,该小组同学认为SO2与FeCl3发生了氧化还原反应。
请设计实验方案检验有Fe2+生成:____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有______(填序号)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 取少量C中反应后的溶液于试管中,向其中加入KSCN溶液,溶液不变红,再加入新制氯水,溶液变红 BC
【解析】
浓硫酸与亚硫酸钠反应生成二氧化硫气体;二氧化硫易溶于水,装置B为防倒吸装置;二氧化硫与氯化铁反应生成硫酸亚铁和氯化亚铁;二氧化硫有毒,D为尾气吸收装置。
(1)Fe3+具有强氧化性,C中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,Fe3+显棕黄色,Fe2+显浅绿色,现象为溶液由棕黄色变成浅绿色。
(2)亚铁离子易被氧化为铁离子,则检验有Fe2+生成的实验方案是:取少量C中反应后的溶液于试管中,向其中加入KSCN溶液,溶液不变红,再加入新制氯水,溶液变红,即可说明含有亚铁离子。
(3)A.浓硫酸与SO2不发生反应,浓硫酸不能代替FeCl3溶液;
B.酸性高锰酸钾溶液具有强氧化性,能将SO2氧化,溶液紫红色褪去,说明SO2具有还原性;
C.碘水中含有I2,具有氧化性,能将SO2氧化,碘水褪色,说明SO2具有还原性;
D.NaCl溶液不与SO2发生反应,不能验证SO2有还原性。
答案为BC。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目