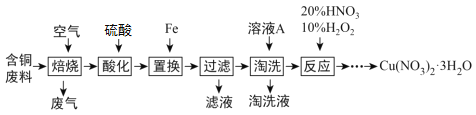
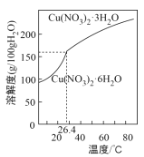
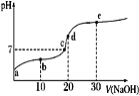
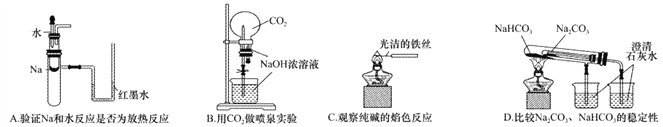
题目内容
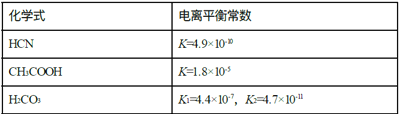
【题目】Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填序号)
a NaCN溶液 b Na2CO3溶液 c CH3COONa溶液 d NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为____________。
Ⅱ.根据下列化合物:①NaOH ②H2SO4 ③CH3COOH ④NaCl ⑤CH3COONa ⑥(NH4)2SO4 ⑦CH3COONH4 ⑧NH4HSO4 ⑨NH3H2O ⑩NH4Cl,请回答下列问题:
(1)常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填“<”、“>”或“=”)。
(2)已知水存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
A 向水中加入NaHSO4固体 B 向水中加NaHCO3固体
C 加热至100℃[其中c(H+)=1×10-6 mol·L-1] D 向水中加入NH4Cl固体
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液中,水电离的OH-浓度由大到小的顺序为(填序号)__________。
(4)物质的量浓度相同的⑥、⑦、⑧、⑨、⑩五种稀溶液中,NH4+浓度由大到小的顺序是(填序号)______。
【答案】b > a > d > c NaCN + CO2 + H2O = HCN + NaHCO3 < D ⑥ > ⑤ > ④ > ③ > ① > ② ⑥ > ⑧ > ⑩ > ⑦ > ⑨
【解析】
Ⅰ.⑴根据电离平衡常数得出酸强弱顺序,根据酸越弱,水解程度越大,碱性越强,pH越大。
⑵根据CH3COOH > H2CO3 > HCN > HCO3-,向NaCN溶液中通入少量CO2生成碳酸氢钠和HCN。
Ⅱ.⑴常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释相同倍数,则强碱pH变化大。
⑵A. 向水中加入NaHSO4固体,电离出氢离子,抑制水的电离;B. 向水中加NaHCO3固体,这是要水解的盐,促进水的电离,平衡向右移动,溶液显碱性;C. 加热至100℃,水的电离是吸热过程,平衡向右移动,但依然是中性;D. 向水中加入NH4Cl固体,要水解的盐,促进水的电离,平衡向右移动,显酸性。
⑶①、②、③是抑制水的电离,④中水的电离既不促进也不抑制,⑤、⑥促进水的电离,等浓度的醋酸根和铵根水解程度相当,但由于硫酸铵中铵根浓度大于醋酸根浓度,因此水解电离的OH-浓度大,①是强碱抑制程度大,②是二元强酸,抑制程度更大,③是一元弱酸,抑制程度弱。
⑷⑦、⑧、⑩电离出铵根浓度相同,⑥电离出铵根浓度是⑦、⑧、⑩电离出铵根浓度的2倍,⑥⑩中铵根单独水解,但⑥中铵根浓度远大于其它几个,⑦中铵根、醋酸根都水解,相互促进的双水解,水解程度大,⑧铵根水解,但电离出的氢离子抑制铵根水解,⑨是弱碱,电离出的铵根浓度少。
Ⅰ.⑴25℃时,根据电离平衡常数得出酸强弱顺序为CH3COOH > H2CO3 > HCN > HCO3-,根据酸越弱,水解程度越大,碱性越强,pH越大,因此物质的量浓度相同的四种溶液的pH由大到小的顺序为b > a > d > c,故答案为:b > a > d > c。
⑵25℃时,向NaCN溶液中通入少量CO2,由于CH3COOH > H2CO3 > HCN > HCO3-,因此只能生成碳酸氢钠和HCN,因此发生反应的化学方程式为NaCN + CO2 + H2O = HCN + NaHCO3,故答案为:NaCN + CO2 + H2O = HCN + NaHCO3。
Ⅱ.⑴常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释相同倍数,则强碱pH变化大,氢氧化钠的pH值比氨水的pH值小,因此要使得稀释后两种溶液的pH都变成9,则弱碱还加水,因此m < n,故答案为:<。
⑵A. 向水中加入NaHSO4固体,电离出氢离子,抑制水的电离,故A不符合题意;B. 向水中加NaHCO3固体,这是要水解的盐,促进水的电离,平衡向右移动,溶液显碱性,故B不符合题意;C. 加热至100℃,水的电离是吸热过程,平衡向右移动,但依然是中性,故C不符合题意;D. 向水中加入NH4Cl固体,要水解的盐,促进水的电离,平衡向右移动,显酸性,故D符合题意,综上所述,答案为D。
⑶①、②、③是抑制水的电离,④中水的电离既不促进也不抑制,⑤、⑥促进水的电离,等浓度的醋酸根和铵根水解程度相当,但由于硫酸铵中铵根浓度大于醋酸根浓度,因此水解电离的OH-浓度大,①是强碱抑制程度大,②是二元强酸,抑制程度更大,③是一元弱酸,抑制程度弱,因此物质的量浓度相同的六种稀溶液中,水电离的OH-浓度由大到小的顺序为⑥ > ⑤ > ④ > ③ > ① > ②,故答案为:⑥ > ⑤ > ④ > ③ > ① > ②。
⑷⑦、⑧、⑩电离出铵根浓度相同,⑥电离出铵根浓度是⑦、⑧、⑩电离出铵根浓度的2倍,⑥⑩中铵根单独水解,但⑥中铵根浓度远大于其它几个,⑦中铵根、醋酸根都水解,相互促进的双水解,水解程度大,⑧铵根水解,但电离出的氢离子抑制铵根水解,⑨是弱碱,电离出的铵根浓度少,因此物质的量浓度相同的五种稀溶液中,NH4+浓度由大到小的顺序是⑥ > ⑧ > ⑩ > ⑦ > ⑨,故答案为:⑥ > ⑧ > ⑩ > ⑦ > ⑨。

 培优口算题卡系列答案
培优口算题卡系列答案【题目】某研究性学习小组为了验证臭氧的氧化性强于氧气,进行了下述实验,请参与探究并回答相关问题。
[实验目的]验证臭氧的氧化性强于氧气。
[实验原理]2KI+O3+H2O=2KOH+I2+O2,淀粉溶液遇单质碘变蓝色。
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计。
[实验步骤]
①取a溶液与碘化钾溶液混合。
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上。
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧。将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
时间(min) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
滤纸的颜色变化 | 玻璃片(Ⅰ)上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
请根据上述实验原理、步骤及你所学的知识,回答下列问题:
(1)实验药品中的a溶液是__________溶液。
(2)写出在臭氧消毒柜中产生O3的化学方程式:_____。
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是_________。
(4)从实验数据记录可以得出的结论是____(填序号)。
A. O3的氧化性比O2强
B. 氧气也能氧化碘化钾中的碘离子
C. 空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
D. O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有9.6 g O3发生反应,则转移的电子的物质的量为_____。