题目内容
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。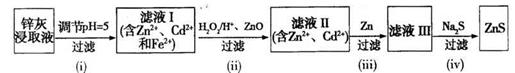
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
(15分)
(1)CH4+Na2SO4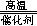 Na2S+CO2+2H2O(3分)
Na2S+CO2+2H2O(3分)
(2)BaCO3+2H+=Ba2++CO2↑+H2O(3分)
沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案)(2分)
(3)①Al(OH)3(2分)
②调节溶液的pH,使Fe3+形成Fe(OH)3沉淀(2分)
③Cd2++Zn=Cd+Zn2+(3分)
解析试题分析:(1)、硫酸钠变为硫化钠时,硫元素由+6价降为—2价,由此推断甲烷中碳元素的化合价升高,由—4价升为+4价,生成CO2,根据最小公倍数法配平可得反应式CH4+Na2SO4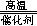 Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,反应式为BaCO3+2H+=Ba2++CO2↑+H2O,而BaSO4不溶于盐酸,但是不能说明Ksp(BaCO3)<Ksp(BaSO4),因为沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案);(3)、①pH=5时,Al3+几乎完全沉淀,则步骤(i)所得滤渣含有铝元素的物质为Al(OH)3;②步骤(ii)所加H2O2/H+的目的可以使Fe2+完全氧化为Fe3+,所加ZnO固体可以消耗溶液中的H+,减小H+浓度,使Fe3+彻底水解为Fe(OH)3沉淀,从而除铁;③步骤(iii)所加Zn能还原Cd2+,反应式为Cd2++Zn=Cd+Zn2+,从而除镉。
Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,反应式为BaCO3+2H+=Ba2++CO2↑+H2O,而BaSO4不溶于盐酸,但是不能说明Ksp(BaCO3)<Ksp(BaSO4),因为沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案);(3)、①pH=5时,Al3+几乎完全沉淀,则步骤(i)所得滤渣含有铝元素的物质为Al(OH)3;②步骤(ii)所加H2O2/H+的目的可以使Fe2+完全氧化为Fe3+,所加ZnO固体可以消耗溶液中的H+,减小H+浓度,使Fe3+彻底水解为Fe(OH)3沉淀,从而除铁;③步骤(iii)所加Zn能还原Cd2+,反应式为Cd2++Zn=Cd+Zn2+,从而除镉。
考点:考查氧化还原反应方程式的书写、混合物的分离与提纯、离子方程式、溶度积、工艺流程、调节溶液pH除去金属阳离子、置换反应除去金属阳离子等相关知识。

 阅读快车系列答案
阅读快车系列答案25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH= (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) = c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
以食盐为原料进行生产并综合利用的某些过程如下图所示: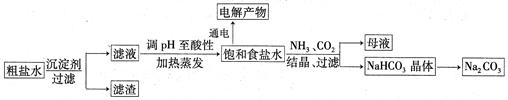
(1)为除去粗盐中的Ca2+、Mg2+和SO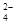 ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:
| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
(2)将滤液的pH调至酸性除去的离子是________,发生反应的离子方程式为________。
(3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下)。假设电解前后溶液的体积不变,则电解后该溶液的pH为______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是___________。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_____________。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的
 (OH-)的比值是_________。
(OH-)的比值是_________。 
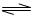 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。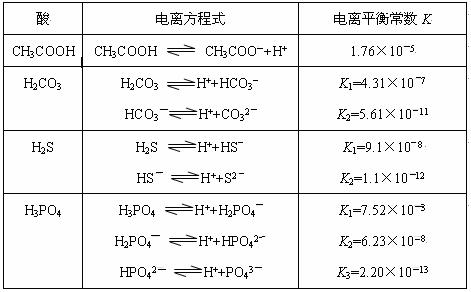


 Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。