题目内容
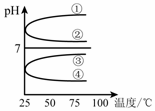
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: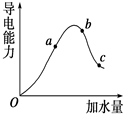
(1) “O”点为什么不导电________.
(2)a,b,c三点的pH由小到大的顺序是____________.
(3) a、b、c三点中电离程度最大的是
电离平衡常数Ka、Kb、Kc的大小关系为________.
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).
A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒
(1)纯净的醋酸不电离,不存在自由离子 (2) b<a<c (3)c Ka=Kb=Kc (4) ACEF
解析试题分析:(1)冰醋酸是纯净的醋酸,只有电解质分子,没有发生电离。没有自由移动的离子所以不能导电。(2)自由移动的离子浓度越大,溶液的导电性就越强。由于导电性b>a>c,所以氢离子的浓度大小顺序是:b>a>c。氢离子的浓度越大,溶液的PH就越小。a,b,c三点的pH由小到大的顺序是b<a<c.(3)加入的水越多,电离的电解质就越多,电离程度就越大。所以 a、b、c三点中电离程度最大的是c.这是在同一温度下的电离。电离平衡常数只与温度有关。所以这三点的电离平衡常数相等。即:a="Kb=Kc" 。(4)A电解质电离过程是个吸热过程,加热,是温度升高,可以使平衡向电离的方向移动,导致c(CH3COO-)增大。正确。B.加很稀的NaOH溶液,消耗了氢离子,减小了氢离子的浓度,是电离平衡向电离的方向移动,但由于是稀溶液,最终氢离子的浓度及c(CH3COO-)反而减小。错误。C.加NaOH固体消耗氢离子,破坏了电离平衡,使电离平衡向电离的方向移动。由于醋酸跟离子没有消耗所以最后c(CH3COO-)增大。正确。D.加水,平衡正向移动,电解质分子的浓度减小。由于电离平衡移动使c(CH3COO-)增大的趋势小于水对它的稀释作用,最后c(CH3COO-反而减小。错误。E.加入CH3COONa固体虽然抑制了醋酸的电离,但加入CH3COONa固体使c(CH3COO-)增大的趋势大于电离平衡逆向移动使c(CH3COO-)减小的趋势 ,最终 c(CH3COO-)增大。正确。F.加入锌粒消耗氢离子,破坏了电离平衡,促使它向电离的方向移动,最终 c(CH3COO-)增大。正确。选项为:A C E F。
考点:考查溶液的导电性与溶液稀释的关系及外界条件对电离平衡的影响的知识。

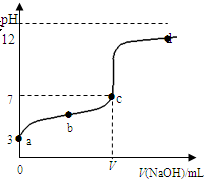
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡状态的表示式_______________、________________;溶液中离子浓度由大到小的顺序是___________________;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是_________________。
(4)该温度下,滴定曲线上c点时HAc的电离平衡常数Ka=_______(用含V的代数简式表示)。
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示: 
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+
 E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )A.4~5 B.6~7 C.9~10 D.11~12
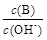 ②
②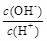 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量