��Ŀ����
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ��������
��1��H��H��O = O��O��H���ļ��ֱܷ�Ϊ�� a kJ/mol��b kJ/mol��c kJ/mol��CH3OH��g����ȼ����Ϊ��H=��d kJ/mol����CO2��g��+3H2��g�� = CH3OH��g��+ H2O��l�� ��H= kJmol��1�����ú�a��b��c��d�Ĵ���ʽ��ʾ��
��2����CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��l��
CH3OCH3��g��+3H2O��l��
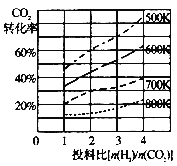
��֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ��ʾ���÷�Ӧ����H 0��������������������¶Ȳ��䣬��С��ӦͶ�ϱ���Kֵ�� �����������С�����䡱����
��3��ij�¶��£������һ�����ܱ�������ͨ��CO2��g����H2��g��������Ӧ�Ʊ������������������������ٷ����仯ʱ���ܱ����������淴Ӧ�ﵽ��ѧƽ����� ��������ĸ����ѡ��
A��������̼��Ũ�� B�������е�ѹǿ
C��������ܶ� D��CH3OCH3��H2O�����ʵ���֮��
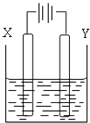
��4���������ѡ�������KOH��Һ�����ȼ�ϵ��Ϊ��Դ����ʯīΪ�缫���500mL���з�̪��NaCl��Һ����ͼ��ʾ����д����ȼ�ϵ�ظ�����Ӧʽ ����ȼ�ϵ������2.8LO2�������ʱ��NaCl��Һ��pH= ����Һ����仯����������������
���𰸡���1��3a+3/2b-6c+d��2����
��2��<��1����������1������3��ABC��2����
��4��CH3OCH3��12e-+16OH-��2CO32-+11H2O��2����14��2����
��������
�����������1���ʱ�=��Ӧ��ļ�������������ܼ�������ӦCO2��g�� + 3H2��g�� �� CH3OH��g�� + H2O��l���ķ�Ӧ����H �� ��3a +3/2b - 6c + d�� kJ��mol-1��
��2��Ͷ�ϱ���ͬʱ�������¶�CO2��ת���ʼ�С���÷�Ӧ�Ħ�H��0��ƽ�ⳣ��ֻ���¶��йأ����¶Ȳ��䣬��С��ӦͶ�ϱ�[n��H2��/n��CO2��]��Kֵ���䡣
��3��A�����ݻ�ѧƽ�ⶨ�壬��Ӧ��Ũ�Ȳ���ﵽƽ��״̬��A��ȷ��B���÷�Ӧ���������ʵ���Ϊ���������������һ�����ܱ������У�ѹǿΪ�����������е�ѹǿ����һ��ƽ�⣬B��ȷ��C���÷�Ӧ��ˮ���ɣ���������Ϊ������������ܶ�Ϊ�������ܶȲ���һ��ƽ�⣬C��ȷ��D��CH3OCH3��H2O���������CH3OCH3��H2O�����ʵ���֮��ʼ��Ϊ1:3����CH3OCH3��H2O�����ʵ���֮�Ȳ��䣬��һ��ƽ�⣬D��������ѡABC��
��4��ԭ����и���ʧȥ���ӣ���������ڸ���ͨ�룬�缫��ӦʽΪCH3OCH3��12e- +16OH-��2CO32- + 11H2O������ȼ�ϵ�ص���������������ȼ�ϵ������2.8L O2���ʵ���=2.8L/22.4L/mol=0.125mol��������ӦΪ��3O2+12H2O+12e-=12OH-������ת��Ϊ0.5mol����˵��ز�������������0.5mol��Ũ����0.5mol��0.5L��1mol/L������Ȼ�����Һ��pH��14��