题目内容
升高温度,下列数据不一定增大的是
| A.化学反应速率 | B.水的离子积常数Kw |
| C.化学平衡常数 | D.弱酸的电离平衡常数Ka |
C
解析试题分析:A、升温,活化分子百分数增大,有效碰撞次数增加,反应速率增大,故A不符合;B、水的电离过程是吸热过程,升高温度电离程度增大,水的离子积增大,故B不符合;C、若正反应为放热反应,升高温度平衡向逆反应移动,化学平衡常数减小,若正反应为吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,故C符合;D、弱电解质的电离是吸热过程,升高温度促进弱电解质的电离,电离平衡常数增大,故D不符合。
考点:考查温度对反应速率、化学平衡常数、水的离子积以及电离平衡常数的影响。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案一定条件下,分别对反应C(S)+CO2(g) 2CO(g)(正反应吸热)进行如下操作(只改变该条件):
①升高反应体系的温度;②增加反应物C的用量;
③缩小反应体系的体积;④减少体系中CO的量。
上述措施中一定能使反应的反应速率显著加快的是( )
| A.①②③④ | B.①③④ | C.①② | D.①③ |
25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)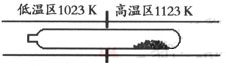
下列说法正确的是( )
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
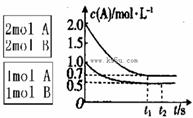
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
| A.x=2 |
| B.2 min内A的反应速率为0.6 mol·L-1·min-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应达到平衡状态 |
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是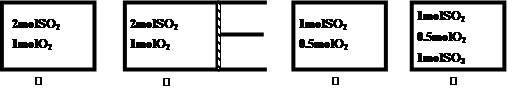
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g) + O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
| A.是吸热反应 | B.是放热反应 | C.是熵减反应 | D.是熵增效应大于能量效应 |
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 xC(g)
xC(g)  <0。测得两容器中c(A)随时间t的变化如图所示:
<0。测得两容器中c(A)随时间t的变化如图所示: