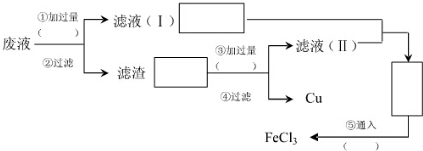
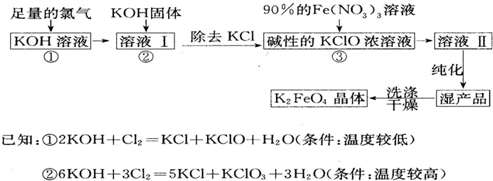
题目内容
6.设计原电池Zn+2Fe3+=Zn2++2Fe2+,在方框中画出能形成稳定半电池形式的装置.(标出电极材料、电解质溶液) 负极:Zn,电极反应:Zn-2e-═Zn2+.
负极:Zn,电极反应:Zn-2e-═Zn2+.正极:Pt,电极反应:2Fe3++2e-═2Fe2+.
分析 由Zn+2Fe3+=Zn2++2Fe2+可知,Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,以此来解答.
解答 解:由Zn+2Fe3+=Zn2++2Fe2+可知,负极为Zn,负极反应为Zn-2e-═Zn2+,
正极为Pt(或石墨或比Zn不活泼金属),正极反应为2Fe3++2e-═2Fe2+,能形成稳定半电池形式的实验装置如图为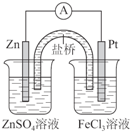 ,
,
故答案为:Zn;Zn-2e-═Zn2+;Pt;2Fe3++2e-═2Fe2+; .
.
点评 本题考查原电池的设计,为高频考点,把握原电池原理、正负极及电极反应等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列说法中,正确的是( )
| A. | 溴元素只存在于海洋中,故溴被称为“海洋元素” | |
| B. | 硅单质是一种半导体材料,也常用于制造光导纤维 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,瓶口有白烟 | |
| D. | 工业炼铁过程加入石灰石的作用是除脉石(SiO2)造渣 |
2.关于阿伏加德罗常数(NA)的下列说法正确的是( )
| A. | 0.1molNa2O2与水反应转移电子数为0.2 NA | |
| B. | 标准状况下,11.2L CCl4中含有的分子数为0.5NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为4NA | |
| D. | 0.2 mol Cl2溶于水中,转移电子数为0.2NA |
4.下列离子方程式书写正确的是( )
| A. | 实验室制Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+2H2O | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | 将铝片打磨后置于NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| D. | 苯酚浊液与纯碱溶液混合后变澄清:2C6H5OH+CO32-=2C6H5O-+CO2↑+H2O |