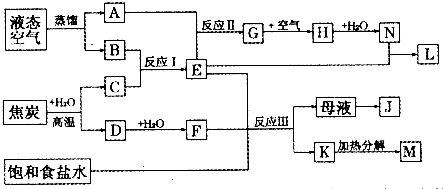
题目内容
16.液氨与水相似,也存在着微弱的自偶电离:2NH3?NH4++NH2-.对该体系的说法中错误的是( )| A. | 一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等 | |
| C. | 液氨的电离达到平衡时,c(NH3)=c(NH2-)=c(NH4+) | |
| D. | 液氨中含有NH3、NH4+和NH2- |
分析 A.液氨中 c (NH4+)与 c (NH2-)的乘积只与温度有关;
B.只要不破坏氨分子的电离平衡,液氨中c (NH4+ )=c (NH2- );
C.液氨电离达到平衡状态时,c (NH4+ )=c (NH2- )小于c (NH3 );
D.可逆反应中的各种微粒都共存.
解答 解:A、一定温度下,液氨中c(NH4+)与c(NH2-)的乘积就是该平衡的平衡常数,故A正确;
B、c(NH4+)和c(NH2-)按1:1生成,故只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等,故B正确;
C、液氨的电离达到平衡时,有 c(NH2-)=c(NH4+),但不一定与c(NH3)相等,故C错误;
D、从电离平衡中可以看出液氨中含有NH3、NH4+和NH2-几种粒子,故D正确;
故选C.
点评 本题考查了电离平衡的特征、粒子种类的判断、平衡常数等,题目难度不大.

练习册系列答案
相关题目
18.下列有机物中,哪一种不可能是醇脱氢直接生成的是:( )
| A. | 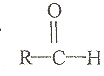 | B. |  | C. | 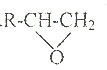 | D. | 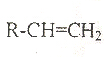 |
4.“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂.其化学名称为“乙酸三氯甲基苯甲酯”,通常用三氯甲基苯基甲醇和醋酸酐为原料制备:
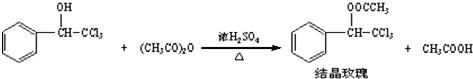
已知:
加料加热3小时,控制温度在110℃粗产品反应液倒入冰水中抽滤
操作步骤和装置如下:$\stackrel{加料}{→}$ $→_{温度在110℃}^{加热3小时,控制}$ $→_{入冰水中}^{反应液倒}$ $\stackrel{抽滤}{→}$粗产品
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌.待混合均匀后,最适宜的加热方式为油浴加热(填“水浴加热”或“油浴加热”).
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
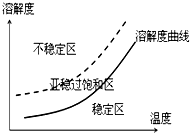
(3)某同学欲在重结晶时获得较大的晶体,查阅资料得到如下信息:
不稳定区出现大量微小晶核,产生较多颗粒的小晶体;
亚稳过饱和区,加入晶种,晶体生长;
稳定区晶体不可能生长
由信息可知,从高温浓溶液中获得较大晶体的操作为加入晶种,缓慢降温.
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是85%.(保留两位有效数字)

已知:
| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
操作步骤和装置如下:$\stackrel{加料}{→}$ $→_{温度在110℃}^{加热3小时,控制}$ $→_{入冰水中}^{反应液倒}$ $\stackrel{抽滤}{→}$粗产品
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌.待混合均匀后,最适宜的加热方式为油浴加热(填“水浴加热”或“油浴加热”).
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在乙醇中,按粗产品、溶剂的质量比为1:$\frac{a}{100}$混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | 70℃时结晶玫瑰在乙醇中溶解 |
| ② | 将步骤1所得溶液冷却结晶 抽滤 | 得到白色晶体 | 在常温下结晶玫瑰在乙醇中溶解度较小 |
| ③ | 干燥步骤2所得白色晶体,加热使其融化,测其熔点 | 白色晶体在88℃左右完全熔化 | 白色晶体是结晶玫瑰 |
不稳定区出现大量微小晶核,产生较多颗粒的小晶体;
亚稳过饱和区,加入晶种,晶体生长;
稳定区晶体不可能生长
由信息可知,从高温浓溶液中获得较大晶体的操作为加入晶种,缓慢降温.
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是85%.(保留两位有效数字)

1. 氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.
氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.
(1)在恒容密闭容器中,发生反应如下:2N2O5(g)?4NO2(g)+O2(g)△H>0.
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率为29.6%;
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.
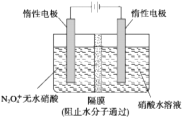
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)标准状况下,将干燥纯净的NH3和NO2气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是AC.
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3•H2O)
D.c(NH4+)+c(NH3•H2O)=1.5c(NO3-)
 氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.
氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.(1)在恒容密闭容器中,发生反应如下:2N2O5(g)?4NO2(g)+O2(g)△H>0.
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率为29.6%;
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)标准状况下,将干燥纯净的NH3和NO2气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是AC.
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3•H2O)
D.c(NH4+)+c(NH3•H2O)=1.5c(NO3-)
8.下列图片与其相关描述正确的共有( )
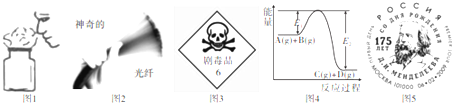
①图1为闻气体时的正确操作
②图2为单质硅的用途之一
③图3为浓硫酸的罐车上所贴的危险化学品标识
④图4反应A(g)+B(g)=C(g)+D(g)为吸热反应
⑤图5为按元素相对原子质量制出第一张元素周期表的俄国化学家门捷列夫纪念币.

①图1为闻气体时的正确操作
②图2为单质硅的用途之一
③图3为浓硫酸的罐车上所贴的危险化学品标识
④图4反应A(g)+B(g)=C(g)+D(g)为吸热反应
⑤图5为按元素相对原子质量制出第一张元素周期表的俄国化学家门捷列夫纪念币.
| A. | 1组 | B. | 2组 | C. | 3组 | D. | 4组 |
5.下列各种冶炼方法中,可制得相应金属的是( )
| A. | 加热Al2O3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氰化钠与铝粉高温共热 |
6.2NO2(g)?N2O4(g)达到平衡后下列条件的改变可使NO2气体浓度增大的是( )
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
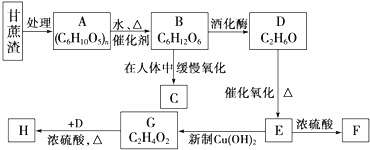
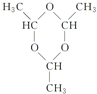 .
.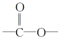 ”结构的链状同分异构体最多有5种(不含H).写出H的不同种类的任意两种同分异构体的结构简式HCOOCH2CH2CH3、CH3CH2CH2COOH.
”结构的链状同分异构体最多有5种(不含H).写出H的不同种类的任意两种同分异构体的结构简式HCOOCH2CH2CH3、CH3CH2CH2COOH.