题目内容
1. 氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.
氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.(1)在恒容密闭容器中,发生反应如下:2N2O5(g)?4NO2(g)+O2(g)△H>0.
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率为29.6%;
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
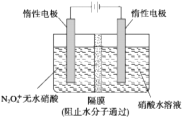
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
(3)标准状况下,将干燥纯净的NH3和NO2气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是AC.
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3•H2O)
D.c(NH4+)+c(NH3•H2O)=1.5c(NO3-)
分析 (1)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②分解速率=$\frac{消耗量}{起始量}$×100%;
③反应的△H>0,升温时平衡正向移动,比较T2 T1时NO2的浓度变化即可;
(2)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
(3)完成喷泉实验后所得溶液等体积混合后生成硝酸铵,利用电离及水解来分析.
解答 解:(1)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,
故答案为:不变;
②下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率=$\frac{5.00mol/L-3.52mol/L}{5.00mol/L}$×100%=29.6%,
故答案为:29.6%;
③T1时,反应到1000s,c(N2O5)为2.48mol/L,反应的c(N2O5)=5.00mol/L-2.48mol/L=2.52mol/L,则c(NO2)=2×2.52mol/L=5.04mol/L,T2时反应到1000s,c(NO2)=4.98mol/L,反应的△H>0,升温时平衡正向移动,所以T2<T1,故答案为:<;
(2)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+;
(3)完成喷泉实验后所得溶液等体积混合后生成硝酸铵,NH4NO3═NH4++NO3-,NH4++H2O?NH3.H2O+H+,则c(NO-3)>c(NH+4)>c(H+)>c(OH-),故A正确,B错误;
由质子守恒可知,c(H+)=c(OH-)+c(NH3.H2O),故C正确;
由物料守恒可知,c(NH4+)+c(NH3.H2O)=c(NO-3),故D错误;
故答案为:AC.
点评 本题考查热化学反应方程式、化学平衡、电离、水解、离子浓度的比较、NO的化学性质等,综合性强,掌握基础是关键,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 整个过程中共发生四个离子反应 | |
| B. | 根据现行可判断酸性强弱为:H2CO3>HAlO2>HCO3- | |
| C. | 通入3mol CO2和通入5mol CO2都只产生3mol沉淀 | |
| D. | 整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示 |
| A. | 该原子的摩尔质量是aNA g/mol | B. | 该原子的相对原子质量为$\frac{12a}{b}$ | ||
| C. | w g该原子的物质的量是$\frac{wb}{12a}$ mol | D. | 由已知信息可得:NA=$\frac{12}{a}$mol-1 |
| A. | 一定温度下,液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 只要不加入其他物质,液氨中c(NH4+)总是与c(NH2-)相等 | |
| C. | 液氨的电离达到平衡时,c(NH3)=c(NH2-)=c(NH4+) | |
| D. | 液氨中含有NH3、NH4+和NH2- |
| A. | 都能通过化合反应实现 | B. | 都能通过置换反应实现 | ||
| C. | 都能通过与单质反应实现 | D. | 变化前后元素化合价都发生了改变 |
| 选项 | a | b | c | 实验现象 |  |
| A | 浓盐酸 | MnO2 | 品红溶液 | 品红褪色 | |
| h | 硫酸 | NaHCO3 | Na2SiO3 | 有白色色胶状沉淀产生 | |
| r | 浓氨水 | 生石灰 | AlCl3溶液 | 白色沉淀生成,后沉淀消失 | |
| D | 70%H2SO4 | Na2SO3 | 紫色石蕊溶液 | 溶液先变红.后褪色 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 晶体硅具有半导体性质,可用于生成光导纤维 | |
| B. | 用Na2O2漂白过的织物,麦秆日久又渐渐变成黄色 | |
| C. | K2FeO4具有氧化性,可用于自来水的杀菌消毒 | |
| D. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 |
| A. | ⅡA族中无非金属元素 | |
| B. | 零族的所有元素均满足最外层电子数为8 | |
| C. | 元素周期表中18个纵行对应18个族 | |
| D. | Ⅷ族中所含元素种类最多 |