题目内容
(10分)工业上制备BaCl2的工艺流程图如图: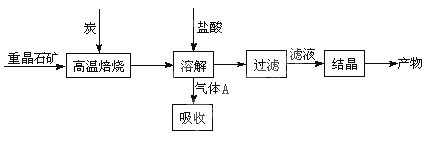
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)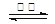 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)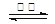 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
| A.Na2S溶液的pH比NaHS溶液pH小 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
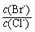 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】(3)反应C(s) + CO2(g)
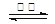 2CO(g)的ΔH =
2CO(g)的ΔH = (4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
(1)S2-+H2O HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原
HS-+OH-;D、E;(2)2.7×10-3;(3)+172.5KJ/mol;(4)炭过量使BaSO4充分还原
解析试题分析:(1)①BaSO4与焦炭在高温下发生反应产生BaS,BaS与盐酸发生反应:BaS+2HCl=BaCl2+H2S↑。H2S 气体被NaOH溶液吸收得到Na2S。Na2S是强碱弱酸盐,弱酸根离子水解使溶液显碱性。水解的离子方程式为S2-+H2O HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O
HS-+OH-。②A.NaHS是H2S 的一级电离产生的,Na2S是H2S 的二级电离产生的,对于多元弱酸来说,一级电离>>二级电离。溶液的酸性主要一级电离决定。根据盐的水解规律:有弱才水解,谁弱谁水解,,越弱越水解,谁强显谁性。所以溶液的碱性Na2S>NaHS。即Na2S溶液的pH比NaHS溶液pH大。错误。B.在两种物质的溶液中都含有Na+、S2-、HS-、H2S、H+、OH-。离子种类相同。错误。C.当向Na2S溶液中加入盐酸时,首先发生S2-+H+=HS-,没有气体产生;然后发生HS-+H+=H2S↑,放出气体。而向NaHS溶液中加入盐酸时立即发生HS-+H+=H2S↑,放出气体。所以两溶液中滴入同体积同浓度的盐酸,产生气体速率不相等。错误。D.当向Na2S和NaHS的溶液中分别加入NaOH溶液时由于增大了OH-离子的浓度,所以水解平衡:S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O
H2S+OH-逆向移动。使c(S2-)都增大。所以正确。E.NaHS=Na++ HS-; HS-发生水解反应 HS-+H2O H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。
H2S+OH-要消耗,所以c(Na+) >c(HS-);HS-水解消耗了水电离产生的H+,使H+的浓度减小,最终当达到水的电离平衡时c(OH-) >c (H+) 。盐的电离远大于弱电解质水的电离,所以c(HS-) >c(OH-)。因此E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+) 。正确。(2)向BaCl2溶液中加入AgNO3和KBr,发生反应:Ag++Cl-="AgCl↓;" Ag++Br-=AgBr↓.Ksp(AgBr)= C(Ag+)·C(Br-) =5.4×10-13; Ksp(AgCl)= C(Ag+)·C(Cl-)=2.0×10-10当两种沉淀共存时,C(Ag+)相同。 。(3) (①-②)÷2可得:反应C(s) + CO2(g)
。(3) (①-②)÷2可得:反应C(s) + CO2(g) 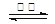 2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。
2CO(g)的ΔH =+172.5KJ/mol;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是使BaSO4充分还原得到BaS。
考点:考查BaSO4的用途、Na2S和NaHS溶液的比较、溶度积常数的应用及热化学方程式的书写等知识。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:__________________________
电解质溶液为KOH溶液的氢氧燃料电池,其负极的电极反应式为____________________________________。
(2)如图表示373 K时,反应A(g)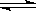 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。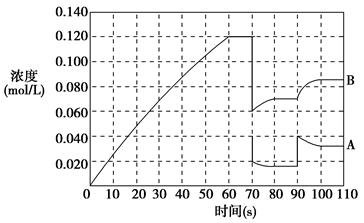
①此反应的平衡常数表达式K=________。
②373 K时反应进行到70 s时,改变的条件可能是________,反应进行到90 s时,改变的条件可能是________。
| A.加入催化剂 | B.扩大容器体积 | C.升高温度 | D.增大A的浓度 |
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。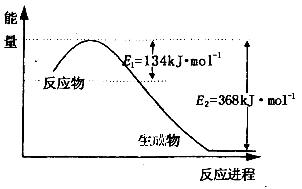
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。

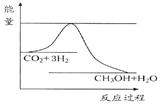
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):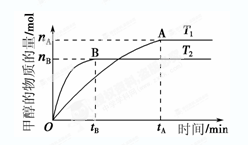
①可逆反应的平衡常数表达式K=
②下列说法正确的是
| A.温度为T1时,从反应开始到平衡,生成甲醇 的平均速率为v(CH3OH)= 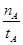 mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;
负极的反应式为 。[来
乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源。按照我国的国家标准,乙醇汽油是用90%的普通汽油与10%的乙醇调和而成。
(1)由粮食或各种植物纤维可得到葡萄糖,写出葡萄糖制得乙醇的化学方程式: 。
(2)在常温常压下,1gC2H5OH完全燃烧生成CO2和液态H2O时放出29.71 kJ热量,表示该反应的热化学方程式为 。
(3)下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: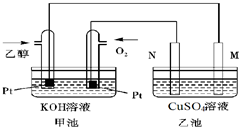
①加入乙醇的Pt电极的电极反应式为_________________________。
②在工作过程中,乙池中两电极均收集到标准状况下224mL气体时,甲池中理论上消耗氧气的体积为 mL(标准状况下);若此时乙池溶液体积为200mL,则乙池中溶液的pH为 。
③若要使②中乙池的溶液完全恢复到起始状态,可向乙池中加入 (填代号)
| A.0.01molCu |
| B.0.01molCuO |
| C.0.01molCu(OH)2 |
| D.0.01molCuCO3 |
F.0.005molCu2(OH)2CO3
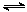 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。