题目内容
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。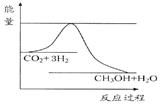
(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
(1)小于 较低 (2)K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)]
(3)增大 (2分) (4)等于(2分)
(5)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1302kJ/mol(2分)
(6)①CH3OH+8OH- - 6e-=CO32- + 6H2O,② 2Cu2++2H2O=Cu+O2↑+4H+, 9.6
解析试题分析:(1)根据该反应的能量关系图知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H小于0;该反应正向为气体物质的量减小的放热反应,ΔH<0,ΔS<0;根据化学反应方向的判据ΔH —TΔS,若该反应自发进行,则有ΔH —TΔS<0,在较低温度下有利于该反应自发进行;(2)根据题给反应方程式知,该反应平衡常数K的表达式为K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)];(3)该反应为放热反应,温度降低,平衡正向移动,平衡常数K增大;(4)根据等效平衡知识知,在一定条件下的可逆反应,无论反应从正向开始,还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态,则达到平衡时,甲容器内n(CH3OH)等于乙容器内n(CH3OH);(5)已知:①CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;②CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;③H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,根据盖斯定律知,②×2+③×4—①×2,得CH3OH燃烧生成CO2和水蒸气的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH="-1302kJ/mol" ;(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。①原电池负极发生氧化反应,甲醇在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OH+8OH- - 6e- =CO32- + 6H2O,②若以石墨为电极,电解硫酸铜溶液,电解的总反应方程式2Cu2++2H2O=2Cu+O2↑+4H+,若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,1.6g甲醇的物质的量为0.05mol,根据电极反应式知,转移的电子为0.3mol,根据电子守恒知,在阴极会析出铜0.15mol,质量为9.6g。
考点:考查化学反应与能量变化、盖斯定律、燃料电池和电化学计算。

中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O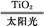 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O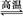 CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。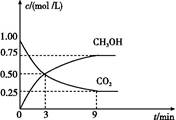
①从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
(10分)工业上制备BaCl2的工艺流程图如图: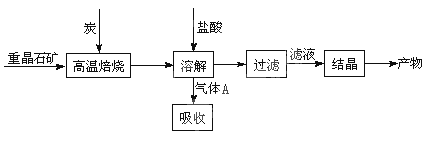
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)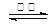 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)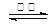 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
| A.Na2S溶液的pH比NaHS溶液pH小 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
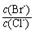 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】(3)反应C(s) + CO2(g)
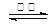 2CO(g)的ΔH =
2CO(g)的ΔH = (4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol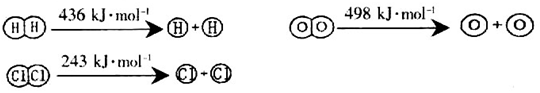
①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K=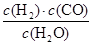 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。
(3)已知反应N2(g)+3H2(g) 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g) 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
②在一定条件下,能判断该反应一定达化学平衡状态的是______(填序号)。
A.3 υ(B)正=2υ(C)逆 B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
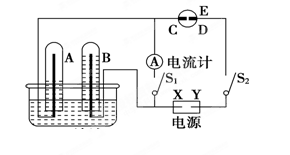
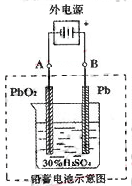
 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):