题目内容
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):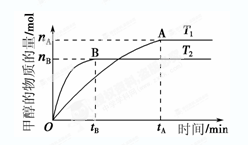
①可逆反应的平衡常数表达式K=
②下列说法正确的是
| A.温度为T1时,从反应开始到平衡,生成甲醇 的平均速率为v(CH3OH)= 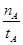 mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;
负极的反应式为 。[来
(1)2858 (2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=" --" 443.5KJ·mol-1
(3)① ②C D ③
②C D ③ (4)O2+4H++4e-=2H2O CH3OH+H2O-6e-=CO2+6H+
(4)O2+4H++4e-=2H2O CH3OH+H2O-6e-=CO2+6H+
解析试题分析:(1)1摩尔的氢气完全燃烧产生稳定的氧化物放出热量为285.8 kJ.则1mol的水分解产生1mol的氢气吸收热量285.8 kJ,则分解10 mol水吸收的能量是2858 kJ。(2) CO燃烧的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g) △H="-283kl/mol;" 液态甲醇完全燃烧的热化学方程式为:②CH3OH(l)+3/2(g)=CO2(g)+ +2H2O(l) △H=-726kl/mol②-①整理得CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=" -" 443.5KJ/mol. (3) ①可逆反应的平衡常数表达式K= .②A 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
.②A 温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=  .错误。B 由于在T1达到平衡时甲醇的物质的量浓度比在T2时大,说明平衡时K1>K2.错误。C.由于在温度为T2时先达到平衡,说明T2>T1。升高温度,甲醇的含量降低,说明平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热方向移动,故正反应为放热反应。正确。D. 处于A点的反应体系从T1升高到T2,达到平衡时n(H2) 增大,n(CH3OH)减小,所以n(H2)/n(CH3OH) 增大。正确。正确选项为CD。③开始时通入1 mol CO2和3 mol H2,充分反应达到平衡后,若CO2的转化率为α,则达到平衡时充分反应达到平衡后,若CO2为(1-α)mol, H2为3(1-α)mol, n(CH3OH)=" α" mol, n(H2O)=" α" mol. 由于是在一密闭恒容容器中,所以容器内的压强与起始压强之比为为反应前后的气体的物质的量的比。平衡时气体的物质的量为(1-α)mol+3(1-α)mol+α mol+ α mol.=(4-2α)mol,开始时气体的物质的量为4mol。故容器内的压强与起始压强之比为(4-2α)mol:4mol=
.错误。B 由于在T1达到平衡时甲醇的物质的量浓度比在T2时大,说明平衡时K1>K2.错误。C.由于在温度为T2时先达到平衡,说明T2>T1。升高温度,甲醇的含量降低,说明平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热方向移动,故正反应为放热反应。正确。D. 处于A点的反应体系从T1升高到T2,达到平衡时n(H2) 增大,n(CH3OH)减小,所以n(H2)/n(CH3OH) 增大。正确。正确选项为CD。③开始时通入1 mol CO2和3 mol H2,充分反应达到平衡后,若CO2的转化率为α,则达到平衡时充分反应达到平衡后,若CO2为(1-α)mol, H2为3(1-α)mol, n(CH3OH)=" α" mol, n(H2O)=" α" mol. 由于是在一密闭恒容容器中,所以容器内的压强与起始压强之比为为反应前后的气体的物质的量的比。平衡时气体的物质的量为(1-α)mol+3(1-α)mol+α mol+ α mol.=(4-2α)mol,开始时气体的物质的量为4mol。故容器内的压强与起始压强之比为(4-2α)mol:4mol= 。(4) 以甲醇为燃料的燃料电池中,电解质溶液为酸性,电池的总反应式为2CH3OH + 3O2=2CO2+4H2O。通入甲醇的电极为负极,负极的反应式为CH3OH+H2O-6e-=CO2+6H+;通入氧气的电极为正极,正极的反应式O2+4H++4e-=2H2O
。(4) 以甲醇为燃料的燃料电池中,电解质溶液为酸性,电池的总反应式为2CH3OH + 3O2=2CO2+4H2O。通入甲醇的电极为负极,负极的反应式为CH3OH+H2O-6e-=CO2+6H+;通入氧气的电极为正极,正极的反应式O2+4H++4e-=2H2O
考点:考查热化学方程式的书写、外界条件对化学平衡的影响、化学平衡常数的计算、表达及燃料电池的反应原理等知识,

 阅读快车系列答案
阅读快车系列答案氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。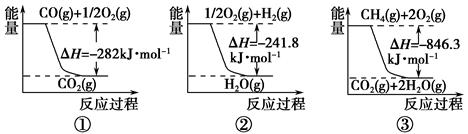
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
(10分)工业上制备BaCl2的工艺流程图如图: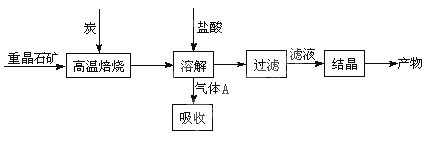
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s)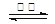 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)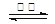 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
| A.Na2S溶液的pH比NaHS溶液pH小 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
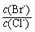 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】(3)反应C(s) + CO2(g)
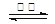 2CO(g)的ΔH =
2CO(g)的ΔH = (4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
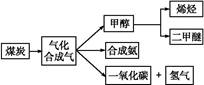
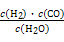 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:  CH3OH(g)
CH3OH(g)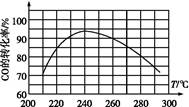
 2NH3(g) ΔH=-92.4 kJ·mol-1
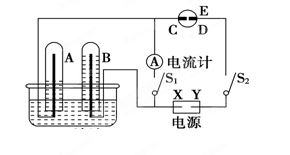
2NH3(g) ΔH=-92.4 kJ·mol-1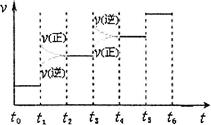
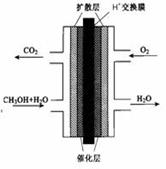
 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 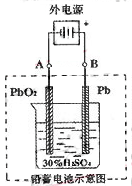
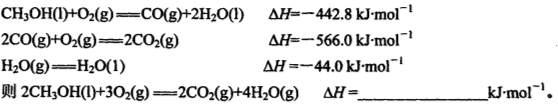
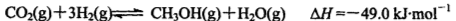
 mol;
mol;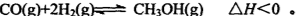

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)