题目内容
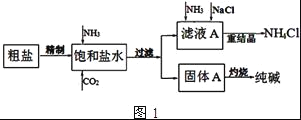
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
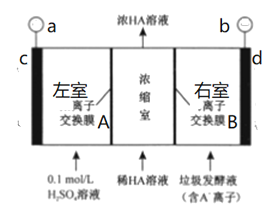
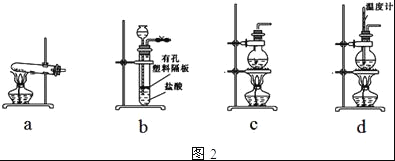
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3bNa2SO4cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
【答案】a c d e b NH3易溶于水,有利于吸收溶解度不大的CO2 NH3溶于水能将HCO3﹣转化为CO32﹣,并增大加入NH4+浓度;加入精盐增大Cl﹣浓度,有利于NH4Cl结晶析出 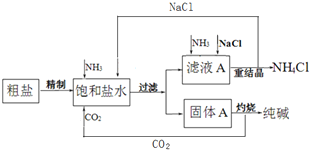 b 浓氨水 称取一定质量的天然碱晶体 加入足量稀硫酸并微热、产生的气体通过足量Ba(OH)2溶液 过滤、洗涤、干燥、称量、恒重沉淀
b 浓氨水 称取一定质量的天然碱晶体 加入足量稀硫酸并微热、产生的气体通过足量Ba(OH)2溶液 过滤、洗涤、干燥、称量、恒重沉淀
【解析】
(1)根据SO42﹣、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)NH3易溶于水,有利于吸收溶解度不大的CO2;根据溶解平衡,增加反应物的浓度有利于晶体析出;
(3)侯氏制碱法主要操作是在氨化饱和的NaCl溶液里通CO2,因此后续操作中得到的CO2和NaCl可循环利用;
(4)实验室制取二氧化碳的反应原理和条件;根据在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:NH3+H2ONH3H2ONH4++OH﹣加入碱或生石灰产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
(5)根据实验的原理:先称取一定量的天然碱晶体并溶解得到水溶液,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数。
(1)SO42﹣、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,故答案为:a→c→d→e→b;
(2)NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通入CO2;通入NH3可通过与HCO3﹣的反应,增加NH4+浓度,并利用精盐增大Cl﹣浓度,根据溶解平衡的移动,有利于NH4Cl结晶析出;
(3)煅烧炉里生成的CO2可循环利用,滤液a析出晶体氯化铵后得到的NaCl溶液可循环利用,则 ;
;
(4)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体![]() 气体;浓氨水中加碱或生石灰,因为氨水中存在下列平衡:NH3+H2ONH3H2ONH4++OH﹣,加入碱平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
气体;浓氨水中加碱或生石灰,因为氨水中存在下列平衡:NH3+H2ONH3H2ONH4++OH﹣,加入碱平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
(5)实验的原理:先称取样品质量并溶解,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数,所以将天然碱晶体样品,溶于适量蒸馏水中,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,然后过滤、洗涤、干燥、称量沉淀即可。

【题目】硫酸是一种重要的化工原料。接触法生产的硫酸产品有98%的硫酸、20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为0.2)。
完成下列计算:
(1)若不计生产过程的损耗,__________m3 SO2(折合成标准状况)经充分转化、吸收,可产出1吨 98%的硫酸(密度为1.84g/mL)。若98%的硫酸可表示为SO3![]() H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
H2O,20%的发烟硫酸可表示为SO3aH2O,则a的值为 ___________(用分数表示)。
(2)铝和铝的化合物在社会生产和人类生活中也有着重要的作用。现有甲、乙两瓶无色溶液,已知它们可能是Na[Al(OH)4]溶液和H2SO4溶液。现经实验获得如下数据:
(已知:2Na[Al(OH)4]+H2SO4→2Al(OH)3↓+Na2SO4+2H2O)
组别 | 甲(mL) | 乙(mL) | 沉淀的物质的量(mol) |
① | 140 | 10 | 0.02 |
② | 10 | 140 | 0.02 |
③ | 20 | 560 | 0.04 |
请通过必要的计算推断过程回答:乙溶液中的溶质是什么________?其物质的量浓度为多少________?
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向两支盛有2 mL相同浓度银氨溶液的试管中滴加2滴相同浓度的NaCl和NaI溶液 | 一支产生黄色沉淀,另一只无明显现象 | Ksp(AgI)<Ksp(AgCl) |
B | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaBr溶液,再滴加2滴0.01 mol/ LNa2S溶液 | 先产生浅黄色沉淀,然后出现黑色沉淀 | Ksp(AgBr)>Ksp(Ag2S) |
C | 向盛有2 mL 0.1 mol/L MgCl2溶液的试管中先滴加2滴2 mol/L NaOH溶液,再滴加2滴0.01 mol/L CuCl2溶液 | 先产生白色沉淀,然后白色沉淀变蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 将H2S通人浓度均为0.01 mol/L的ZnSO4和CuSO4混合液中 | 先产生黑色的CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D