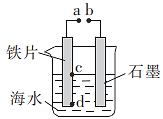
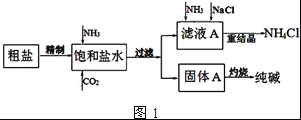
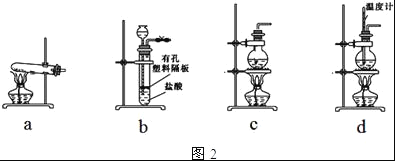
��Ŀ����
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϡ��Ӵ��������������Ʒ��98�������ᡢ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2����
������м��㣺
��1���������������̵���ģ�__________m3 SO2���ۺϳɱ�״���������ת�������գ��ɲ���1�� 98%�����ᣨ�ܶ�Ϊ1.84g/mL������98��������ɱ�ʾΪSO3![]() H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
H2O��20���ķ�������ɱ�ʾΪSO3aH2O����a��ֵΪ ___________���÷�����ʾ����
��2���������Ļ��������������������������Ҳ������Ҫ�����á����мס�����ƿ��ɫ��Һ����֪���ǿ�����Na[Al��OH��4]��Һ��H2SO4��Һ���־�ʵ�����������ݣ�
����֪��2Na[Al��OH��4]+H2SO4��2Al��OH��3��+Na2SO4+2H2O��
��� | �ף�mL�� | �ң�mL�� | ���������ʵ�����mol�� |
�� | 140 | 10 | 0.02 |
�� | 10 | 140 | 0.02 |
�� | 20 | 560 | 0.04 |
��ͨ����Ҫ�ļ����ƶϹ��̻ش�����Һ�е�������ʲô________�������ʵ���Ũ��Ϊ����________��
���𰸡�224 ![]() ��ΪNa[Al��OH��4]��Һ Ũ��Ϊ��8.5 mol��L-1
��ΪNa[Al��OH��4]��Һ Ũ��Ϊ��8.5 mol��L-1
��������
��1������SO2��SO3��H2SO4��֪��Ҫ������������Ϊ![]() =2.24��105L=224m3��20%�ķ���H2SO4��ʾΪSO3aH2O����Ϊ��aH2SO4����1-a��SO3����Ϊ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2��������20%��������H2SO4��SO3��������ϵ�ɵã�98a��80(1-a)=(1-20%)��20%����ã�a=
=2.24��105L=224m3��20%�ķ���H2SO4��ʾΪSO3aH2O����Ϊ��aH2SO4����1-a��SO3����Ϊ20���ķ������ᣨH2SO4��SO3�Ļ�������SO3����������Ϊ0.2��������20%��������H2SO4��SO3��������ϵ�ɵã�98a��80(1-a)=(1-20%)��20%����ã�a=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��������ΪH2SO4������Al��OH��3���������ᣬ��ٵ��ڹ�����Na[Al��OH��4]���٣�H2SO4���ӵĹ����У����ɳ�����Ȼ���٣���ʵ��������ɳ���û�м��٣�˵�����������ΪNa[Al��OH��4]���ڵ��۵Ĺ�������������һ����Na[Al��OH��4]���Ӷ���һ�����������պö���һ����˵���ڢ���Na[Al��OH��4]������������ȫ��Ӧ�����ݢڽ�Ϸ���ʽ2Na[Al��OH��4]+H2SO4��2Al��OH��3��+Na2SO4+2H2O��֪10mL������Һ����������ʵ�����0.01mol���������������Ϊ0.01mol��14=0.14mol��H+�����ʵ���=0.28mol���ڢ��з����ķ�Ӧ��������4H++[Al��OH��4]-=Al3++4H2O��Al3++3[Al��OH��4]-=4Al��OH��3�����ɷ���ʽ��֪����Na[Al��OH��4]�����ʵ���= 0.07mol+0.15mol=0.085mol��������Ũ����![]() mol��L-1���ʴ�Ϊ����ΪNa[Al��OH��4]��Һ��Ũ��Ϊ��8.5 mol��L-1��
mol��L-1���ʴ�Ϊ����ΪNa[Al��OH��4]��Һ��Ũ��Ϊ��8.5 mol��L-1��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�