��Ŀ����
����Ŀ��ijС��ͬѧ�����ƣ����岽�����£�
![]()
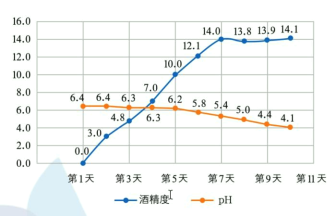
��ʱ����õ�ʵ������ͼ���£�
����˵������ȷ����
A.Ŵ���е����ھ������ǻ�ø������ˮ��Ϊ�����ǣ��������ھƻ�ø������ת��Ϊ�Ҵ�
B.����������� pH ���½�����������Ϊ�����Ҵ�����������Ϊ����
C.�ӵ� 7 �쿪ʼ�Ƶľƾ��Ƚ������䣬˵����Һ�е��������Ѿ���ȫ��Ӧ
D.��С������������ƾƾ��Ȳ��ߣ��ɲ���������߾ƾ���
���𰸡�B
��������
A. Ŵ���е����ھ������ǻ�ø������ˮ��Ϊ�����ǣ��������ھƻ�ø������ת��Ϊ�Ҵ�����A��ȷ��
B. ����������� pH ���½�����������Ϊ���������黯ø�������²��������ᣬ�Ӷ�ʹ��pH���ͣ���B����
C. �ӵ� 7 �쿪ʼ�Ƶľƾ��Ƚ������䣬˵����Һ�оƾ��������ɣ��������Ѿ���ȫ��Ӧת��Ϊ�ƾ�����C��ȷ��
D. ��С������������ƾƾ��Ȳ��ߣ�Ϊ����߾ƾ��ȿɲ�������������D��ȷ��
������������ΪB��

 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�����Ŀ��25��ʱ��������ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1��һ������£����¶�����ʱ��Ka________(����������������С������������)��
��2�������������ӽ��H+�����ɴ�С��˳����______________________(����ĸ)��
a.CO32�� b.ClO�� c.CH3COO�� d.HCO3��
��3�����з�Ӧ���ܷ�������________(����ĸ)��
a. CO32����2CH3COOH��2CH3COO����CO2����H2O
b. ClO����CH3COOH��CH3COO����HClO
c. CO32����2HClO��CO2����H2O��2ClO��
d. 2ClO����CO2��H2O��CO32����2HClO
��4��������ˮϡ�ʹ��ᣬ���и�ʽ��ʾ����ֵ��ˮ�������Ӷ��������______(����ĸ)��
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
��5�������Ϊ10 mL��pH��Ϊ2�Ĵ�����Һ��HX��Һ�ֱ��ˮϡ����1000 mL��ϡ������pH�仯����ͼ��ʾ��
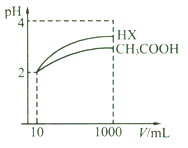
��HX�ĵ���ƽ�ⳣ��________(����>������=������<������ͬ)����ĵ���ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c(H+)_____������Һ��ˮ���������c(H+)����ͬŨ�ȵ�NaOH��Һ�ֱ��к�������������Һ��ǡ���к�ʱ����NaOH��Һ�����������____HX��
��6��25��ʱ�����CH3COOH��CH3COONa�Ļ����ҺpH��6������Һ��c(CH3COO��)-c(Na+)��________mol��L-1(�ȷ��ֵ)��
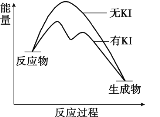
����Ŀ����20 mL 0.40 mol/L H2O2��Һ�м�������KI��Һ������H2O2+I-=H2O+IO��������H2O2+IO��= H2O+O2��+ I����H2O2�ֽⷴӦ�����������仯�Ͳ�ͬʱ�̲������O2�����(�������״��)���¡�
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
�����ж�����ȷ����
A. ��ͼ�п��Կ�����KI������H2O2�ķֽ�����
B. ��Ӧ���Ƿ��ȷ�Ӧ����Ӧ�������ȷ�Ӧ
C. 0~10 min��ƽ����Ӧ���ʣ�v(H2O2)��9.0��10-3 mol/(L��min)
D. H2O2�ڷ�Ӧ�����м������������ԣ��������˻�ԭ��
����Ŀ��������ʵ����ʵ���������������Ӧ������ȷ���ǣ� ��
ѡ�� | ʵ����ʵ����� | ���� |
A | ����������ͬ�� | ��������������ʱ������Ӧ��Ũ�Ȼ�ѧ��Ӧ���ʼӿ� |
B | �ڻ�ѧ��Ӧǰ�����������ͻ�ѧ���ʶ�û�з����ı� | ����һ�������뻯ѧ��Ӧ |
C | ���ʵ���Ũ����ͬ������ʹ���ֱ������������״��ͬ��п����Ӧ | ��ʼʱ�ķ�Ӧ������ͬ |
D | ���ݻ��ɱ���ܱ������з�����Ӧ | ����Ӧ���ʼӿ죬�淴Ӧ���ʲ��� |
A. AB. BC. CD. D