题目内容
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合H+能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释醋酸,下列各式表示的数值随水量的增加而增大的是______(填字母)。
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
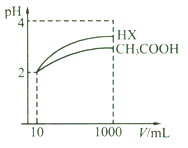
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
(6)25℃时,测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
【答案】增大 a>b>d>c cd b > > > 9.9×10-7 moL·L-1
【解析】
(1)弱电解质的电离一般是吸热的过程,升高温度,Ka增大;
(2)酸性越强,酸根离子结合氢离子的能力越弱,据此分析;
(3)由以上分析可知酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-,根据强酸制弱酸的规律进行判断;
(4)醋酸属于弱电解质,加水稀释后促进了醋酸的电离,使n(H+)、n(CH3COO-)增大,n(CH3COOH)减小,但加水以后溶液的体积增大,导致c(H+)、c(CH3COO-)、c(CH3COOH)减小,据此分析问题;
(5)等体积、等pH的不同一元酸稀释相同的倍数,pH数值变化较大的是强酸,变化较小的是弱酸,酸性越强,电离平衡常数就越大;用同浓度的氢氧化钠与两溶液反应,消耗氢氧化钠的体积与物质的量成正比;
(6)依据电荷守恒进行计算。
(1)弱电解质的电离一般是吸热的过程,升高温度,Ka增大;
(2)电离常数越大,越容易电离,因而酸性强弱有CH3COOH>H2CO3>HClO>HCO3-,酸性越强,酸根离子结合氢离子的能力越弱,那么结合质子的能力大小关系为:CO32->ClO->HCO3->CH3COO-,即a>b>d>c ;
(3)由以上分析可知酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-,
a. CH3COOH>H2CO3,反应可以发生,a项错误;
b. CH3COOH>HClO,反应可以发生,b项错误;
c. H2CO3>HClO,反应不能发生,c项正确;
d. H2CO3>HClO>HCO3-,反应不能发生,应生成HCO3-和HClO,d项正确;
答案选cd。
(4)醋酸属于弱电解质,加水稀释后促进了醋酸的电离,使n(H+)、n(CH3COO-)增大,n(CH3COOH)减小,但加水以后溶液的体积增大,导致c(H+)、c(CH3COO-)、c(CH3COOH)减小;
a. H+物质的量增大, CH3COOH物质的量减小,故c(CH3COOH)/c(H+)的比值减小,a项错误;
b. CH3COO-物质的量增大, CH3COOH物质的量减小,故c(CH3COO-)/c(CH3COOH)的比值增大,b项增大;
c. c(H+)减小,温度不变,水的离子积常数不变,则c(H+)/Ka的比值减小,c项错误;
d. c(H+)减小,温度不变,水的离子积常数不变,则c(OH-)增大,有c(H+)/c(OH-)的比值减小,d项错误;
答案选b;
(5)等体积、等pH的不同一元酸稀释相同的倍数,pH数值变化较大的是较强的酸,变化较小的是较弱的酸,故酸性HX>CH3COOH;酸性越强,电离平衡常数就越大,因而电离平衡常数HX>CH3COOH;酸能抑制水的电离,c(H+)越大越抑制水的电离,则稀释后c(H+):CH3COOH>HX,即HX溶液中水电离出来的c(H+)>醋酸溶液中水电离出来的c(H+);用同浓度的氢氧化钠与两溶液反应,消耗氢氧化钠的体积与物质的量成正比,pH相同,体积相同的这两种酸的物质的量CH3COOH>HX,即消耗NaOH溶液的体积:CH3COOH>HX;
(6)CH3COOH与CH3COONa的混合溶液pH=6,说明c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒有:c(CH3COO-)+ c(OH-)= c(H+)+ c(Na+),那么c(CH3COO-)- c(Na+) = c(H+)- c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L.

 名校课堂系列答案
名校课堂系列答案