题目内容
18. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol) -1
①该反应能否自发进行与温度 有关.
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc (填字母,下同)
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2molH-O键
c.υ正(CO)=υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应
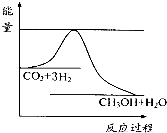
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
分析 (1)①根据△G=△H-T△S判断,△G<0,反应自发进行;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应
(3)要使c(CH3OH)增大,平衡正向移动.
解答 解:(1)①由热化学反应方程式可知,反应为焓增,熵增过程,即△H>0、△S>0,△G=△H-T△S<0反应自发进行,所以该反应自发进行,受温度影响,298℃时,△H=+131.3kJ•mol-1△S=+133.7J•mol-1•K-1,△G=△H-T△S=+131.3kJ•mol-1-(298+273)K×(+133.7×10-3KJ•mol-1)•K-1=54.96KJ/mol>0,说明反应非自发进行;
故答案为:温度;
②a.一定温度下,在一个容积可变的密闭容器中发生上述反应,反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,压强增大,保持恒压,容器中的压强始终不变,不能说明反应到达平衡,故a错误;
b.1 molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确.
c.反应速率之比等于化学方程式计量数之比,v正(CO)=v逆(H2O),说明水的正反应速率和逆反应速率相同,反应达到平衡状态,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选:bc;
(2)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/L•min,速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.16mol/(L•min)=0.16mol/(L•min),
故答案为:0.16mol/(L•min);
②实验1中CO的转化率为$\frac{4mol-2.4mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{2mol-1.6mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,逆反应是吸热反应;
故答案为:吸;
(3)a.升高温度,平衡逆向,故不选;
b.充入He(g),使体系压强增大,反应物的浓度不变,平衡不移动,故不选;
c.将H2O(g)从体系中分离出来,平衡正向移动,故选;
d.再充入1mol CO2和3mol H2,相当于增大压强,平衡正向移动,故选;
故答案为:cd.
点评 本题考查化学平衡状态判断、反应的自发以及化学平衡移动等问题,为高频考点,把握影响因素及平衡特征为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 温度 | B. | 压强 | C. | 反应物本身性质 | D. | 催化剂 |
| A. | 碳酸钠溶于足量盐酸中 Na2CO3+2H+=2Na++CO2↑+H2O | |
| B. | 氧化钠与稀硫酸的反应 Na2O+2H+=2Na++H2O | |
| C. | 氢氧化钡溶液与硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铁片插入稀硫酸溶液中 Fe+2H+=Fe3++H2↑ |
| A. | 升高温度,降低压强,增加氮气 | B. | 降低温度,增大压强,加入催化剂 | ||
| C. | 升高温度,增大压强,增加氮气 | D. | 降低温度,增大压强,分离出部分氨 |
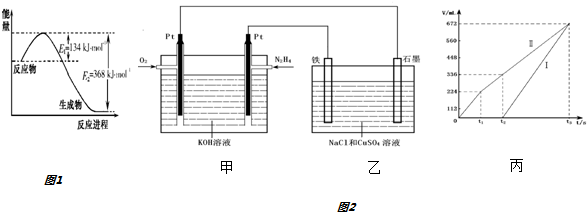
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的 关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4 做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.
某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图2所示.
①该燃料电池的负极反应式为N2H4+4OH--4e-=N2↑+4H2O;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图中曲线 I、II所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L
③在t2时所得溶液的pH为1.(假设溶液体积不变)
| A. | 油脂水解后的产物经氧化为人体提供能量 | |
| B. | 多摄入动物脂肪对人体有害 | |
| C. | 油脂能保持体温,保护内脏器官 | |
| D. | 油脂能促进VB、VC的吸收 |
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 在一个确定的化学反应体系中,反应物的总能量总是高于生成物的总能量 |
 和
和