题目内容
17.硫酸是一种实验室常用的化学试剂.请按要求填空:(1)浓硫酸试剂瓶上适合贴上的图标是C(图甲)(填写字母标号).

(2)用图乙所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的A 和C(填写字母标号)
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(3)装置①中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量C(填写字母标号)
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(4)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液,装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;装置②中主要反应的氧化剂和还原剂物质的量之比是1:2;
根据装置③观察到有白色沉淀生成的现象不能(填“能”或“不能”)判断该白色沉淀一定只有CaCO3.
分析 (1)浓硫酸具有强的氧化性而具有强的腐蚀性,属于腐蚀品;
(2)铜和浓硫酸反应生成二氧化硫,结合二氧化硫的性质解答;
(3)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,随着反应进行浓硫酸浓度降低,变为稀硫酸与铜不反应;
(4)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水;氢硫酸与二氧化硫反应生成硫和水,依据方程式判断解答;
解答 解:(1)浓硫酸为腐蚀品,应选择:图标C;
故答案为:C;
(2)铜和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,可先后品红检验,因二氧化硫有毒,不能排放到空气中,可用氢氧化钠吸收,
故答案为:A;C;
(3)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;铜6.4g和含有0.2molH2SO4的浓硫酸,如果硫酸完全反应则生成二氧化硫质量等于6.4g,但是随着反应进行浓硫酸浓度降低,变为稀硫酸与铜不反应,所有生成二氧化硫的质量小于6.4g,故选:C;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; C;
(4)碳和浓硫酸在加热条件下发生氧化还原反应生成二氧化碳和二氧化硫,反应的方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,硫化氢和二氧化硫发生:2H2S+SO2=3S↓+2H2O,由方程式可知,氧化剂和还原剂的物质的量之比是1:2,反应生成的CO2和SO2都可与澄清石灰水反应生成沉淀,则沉淀不一定为CaCO3,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O; 1:2; 不能.
点评 本题考查了浓硫酸性质,熟悉浓硫酸强氧化性是解题关键,注意铜与浓硫酸反应的条件,题目难度不大.

| A. | Mg | B. | Al | C. | Zn | D. | Cu |
| A. | Na原子结构示意图: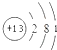 | B. | Cl-结构示意图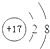 | ||
| C. | O的原子结构示意图: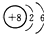 | D. | Al3+结构示意图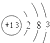 |
| A. | 向100mL3 mol/L的硝酸中加入5.6g铁 | |
| B. | 用40mL10 mol/L的盐酸与10g二氧化锰共热制取氯气 | |
| C. | 标准状况下,将1g铝片投入20mL18.4mol/L的硫酸中 | |
| D. | 在50MPa、500℃和铁触媒催化的条件下,用1.2mol氮气和3mol氢气合成氨 |
 NaCl
NaCl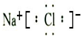 H2O2
H2O2
 2,3,5-三甲基己烷;
2,3,5-三甲基己烷;  2,4-二甲基己烷.
2,4-二甲基己烷.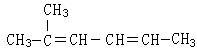 2-甲基-2,4-已二烯
2-甲基-2,4-已二烯 3,4-二甲基-2-戊醇
3,4-二甲基-2-戊醇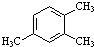 1,2,4-三甲基苯.
1,2,4-三甲基苯. .以下对苯甲酸钠描述错误的是C.
.以下对苯甲酸钠描述错误的是C.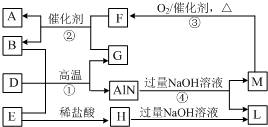 AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去).请回答下列问题:
AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去).请回答下列问题: .
.