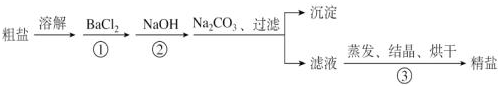
题目内容
18.下列溶液中有关物质的量浓度关系正确的是( )| A. | pH=2的HA溶液与pH=12的MOH(强碱)溶液等体积混合溶液一定显碱性 | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等 |
分析 A.若HA为强酸,则两溶液等体积混合后溶液呈中性,当HA为弱酸时,混合液中HA过量,溶液呈酸性;
B.氢氧化钠为强碱,浓度相等时其浓度最大;碳酸钠的水解程度大于醋酸钠,则碳酸钠溶液的pH大于醋酸钠;
C.根据碳酸氢钠溶液中的质子守恒判断;
D.两溶液中的氢离子浓度相等,但温度升高后水的离子积最大,则两溶液中氢氧根离子浓度不相等.
解答 解:A.pH=2的HA溶液与pH=12的MOH(强碱)溶液等体积混合,当HA为强酸时,二者恰好反应生成MA,溶液显示中性,当HA为弱酸时,混合液中HA过量,溶液呈酸性,故A错误;
B.物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液,NaOH为强碱,则浓度相等时其pH最大,碳酸根离子的水解程度大于醋酸根离子,则浓度相等时:pH(Na2CO3)>pH(CH3COONa),所以溶液pH大小为:pH(NaOH)>pH(Na2CO3)>pH(CH3COONa),故B错误;
C.NaHCO3溶液中,根据质子守恒可得:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),则:c(OH-)-c(H+)=c(H2CO3)-c(CO32-),故C正确;
D.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中的氢离子浓度相等,由于温度升高后水的离子积最大,则两溶液中的c(OH-)不相等,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 高温结构陶瓷材料Si3N4固体是分子晶体 | |
| C. | 分子晶体在水溶液中一定导电 | |
| D. | NaCl和HCl溶于水时,均破坏都是离子键 |
13.取一块金属钠放在燃烧匙里加热,观察到下列现象:①金属先熔化;②在空气中燃烧,产生黄色火花;③燃烧后得到白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质.描述正确的是( )
| A. | ①② | B. | ①②③ | C. | ①④ | D. | ①④⑤ |
10.3g一氧化碳和氢气的混合气体与足量的氧气充分反应后,在150℃时将混合气体通过足量的过氧化钠后,过氧化钠增加的质量为( )
| A. | 1.5g | B. | 3g | C. | 6g | D. | 无法计算 |
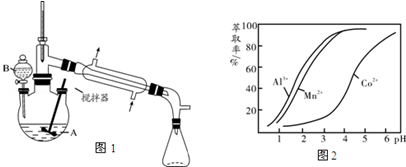
13.实验室制备环己酮的反应原理为: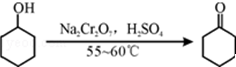 其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物
①仪器B的名称是分液漏斗.
②蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出.
(2)用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有毒的Na2Cr2O7.
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156℃馏分,得到精品 b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是c d b a(填序号)
②在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
(4)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如图2所示.现有某钴矿石的盐酸浸出液,浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围应控制在b.
a.2.0~2.5 b.3.03.5 c.4.0~4.5.
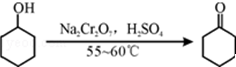 其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
其反应的装置示意图如图1(夹持装置、加热装置略去):环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物
①仪器B的名称是分液漏斗.
②蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出.
(2)用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是避免使用有毒的Na2Cr2O7.
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156℃馏分,得到精品 b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是c d b a(填序号)
②在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失.
(4)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如图2所示.现有某钴矿石的盐酸浸出液,浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围应控制在b.
a.2.0~2.5 b.3.03.5 c.4.0~4.5.