题目内容
10.3g一氧化碳和氢气的混合气体与足量的氧气充分反应后,在150℃时将混合气体通过足量的过氧化钠后,过氧化钠增加的质量为( )| A. | 1.5g | B. | 3g | C. | 6g | D. | 无法计算 |
分析 CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;、2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量,据此分析解答.
解答 解:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;、2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量,所以将一氧化碳和氢气的混合气体与足量的氧气充分反应后,在150℃时将混合气体通过足量的过氧化钠后,过氧化钠增加的质量就等于氢气和CO的质量为3g,故选B.
点评 本题考查化学方程式有关计算,为高频考点,正确判断二氧化碳、水和过氧化钠反应中固体质量增加实质是解本题关键,侧重考查学生分析问题能力,题目难度不大.

| A. | CaH2既是还原剂,又是氧化剂 | B. | H2既是氧化产物,又是还原产物 | ||
| C. | CaH2是还原剂,H2O 是氧化剂 | D. | 氧化产物与还原产物质量比为1:1 |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)彼此互为同系物的是(填序号):④⑤.
(4)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:nCH2=CH2$\stackrel{引发剂}{→}$
 .
.(5)甲苯的一氯取代产物有4种.
| A. | pH=2的HA溶液与pH=12的MOH(强碱)溶液等体积混合溶液一定显碱性 | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等 |
| A. | 三氯化铁可用作净水剂,是因为氢氧化铁胶体具有吸附性 | |
| B. | 氢氧化铁胶粒直径在10-9一10-7m之间 | |
| C. | 氯化铁溶液转变成氢氧化铁胶体是化学变化,氢氧化铁胶体变成氢氧化铁沉淀是物理变化 | |
| D. | 氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水 |
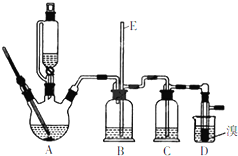 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g.cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)装置A、D中发生主要反应的化学方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br.
(2)装置B中长玻璃管E的作用:判断装置是否堵塞.
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入c,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.酸性KMn04溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是:溴易挥发,冷水可减少挥发;但又不能过度:冷却(如用冰水),其原因是:如果用冰水冷却会使产品凝固而堵塞导管;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
| A. | 无水硫酸铜 | B. | 硫酸亚铁 | C. | 食盐 | D. | 生石灰 |
| A. | 化学键 | B. | 化学键、分子间作用力 | ||
| C. | 分子间作用力、化学键 | D. | 分子间作用力、分子间作用力 |