题目内容
9.标出下列化学方程式中电子转移的方向及数目,并指出氧化剂和还原剂:(1)Cl2+H2O?HCl+HClO
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(3)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
(4)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 (1)Cl元素的化合价既升高又降低,转移e-;
(2)Cu元素的化合价升高,N元素的化合价降低,转移2e-;
(3)O元素的化合价升高,Cl元素的化合价降低,转移12e-;
(4)Cl元素的化合价升高,Mn元素的化合价降低,转移2e-.
解答 解:(1)该反应中Cl元素化合价由0价变为+1价、Cl2为还原剂,Cl元素化合价又由0价降低为-1价,则Cl2为氧化剂,其得失电子最小公倍数是1,用双线桥标出该反应电子转移的方向和数目为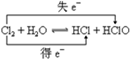 ,故答案为:
,故答案为: ;氧化剂Cl2,还原剂Cl2;
;氧化剂Cl2,还原剂Cl2;
(2)该反应中Cu元素化合价由0价变为+2价、Cu为还原剂,部分N元素化合价由+5价变为+4价,则HNO3为氧化剂,其得失电子最小公倍数是2,用双线桥标出该反应电子转移的方向和数目为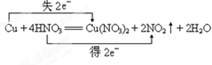 ,
,
故答案为: ;氧化剂HNO3;还原剂Cu;
;氧化剂HNO3;还原剂Cu;
(3)该反应中O元素的化合价升高-2价升高为0价,则KClO3为氧化剂;Cl元素化合价从+5价降低为-1价,则KClO3为还原剂,其得失电子最小公倍数是12,用双线桥标注电子转移为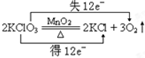 ,
,
故答案为: ;氧化剂KClO3;还原剂KClO3;
;氧化剂KClO3;还原剂KClO3;
(4)该反应中Cl元素部分化合价由-1价升高为0价、Cl2为还原剂,Mn元素化合价由+4价降低为+2价,则MnO2为氧化剂,其得失电子最小公倍数是2,用双线桥标出该反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;氧化剂MnO2,还原剂HCl.
;氧化剂MnO2,还原剂HCl.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子表示方法的考查,题目难度不大.

练习册系列答案
相关题目
19.在工业生产中,硫酸不能用于( )
| A. | 制化肥 | B. | 制漂白粉 | ||
| C. | 酸洗 | D. | 医药、制炸药、农药 |
20.铜可以用来制作导线,铜的下列性质与此无关的是( )
| A. | 铜有优良的导电性 | B. | 铜在干燥的空气中不易被氧化变质 | ||
| C. | 铜较易冶炼,属常见金属 | D. | 铜的密度比较大 |
17.某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |
1.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )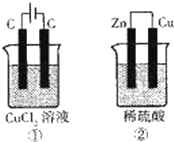

| A. | 产生气体的体积:①>② | |
| B. | 两极上析出物质的质量:①>② | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①中阳极:4OH--→2H2O+O2↑+4e-;②中阴极:2H++2e--→H2↑ |
18.在[Fe(CN)6]3-配离子中,中心离子的配位数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |