题目内容
【题目】(1)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是__________;1 mol该配离子中含σ键数目为________。
②该配合物中存在的作用力类型有_________(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(2)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为a nm。则硼原子与磷原子最近的距离为__________。 用M g·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为__________g·cm-3。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中3原子1的坐标为(1/2,1/2,0),则原子3的坐标分别为________________。

【答案】![]() 12 NA BCD
12 NA BCD ![]() anm
anm ![]() (1/4,3/4,3/4)
(1/4,3/4,3/4)
【解析】
(1)![]() 中碳氮之间为叁键,电子式为
中碳氮之间为叁键,电子式为![]() ,共价三键由一个σ键,两个π键组成,故1个
,共价三键由一个σ键,两个π键组成,故1个![]() 中含有1个σ键,
中含有1个σ键,![]() 中的配位键也是σ键,共6个配位键,故1 mol
中的配位键也是σ键,共6个配位键,故1 mol![]() 中含σ键数目为
中含σ键数目为![]() ,
,![]() 中
中![]() 中存在共价键,
中存在共价键, ![]() 与亚铁离子之间络合存在配位键,钾离子与
与亚铁离子之间络合存在配位键,钾离子与![]() 之间存在离子键,故选BCD;
之间存在离子键,故选BCD;
答案为: ![]() ;
;![]() ;BCD
;BCD
(2)硼原子和磷原子的最近距离为晶胞的体对角线的![]() ,即
,即![]() nm,根据均摊原则,每个晶胞含有4个硼原子,4个磷原子,
nm,根据均摊原则,每个晶胞含有4个硼原子,4个磷原子,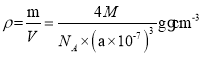 ,
,
故答案为:![]() nm;
nm;![]() ;
;
(3)将该晶胞切成8等份,即8个小立方体,原子3位于左上方立方体的体心,根据原子1的坐标为(1/2,1/2,0),故原子3的坐标为(1/4,3/4,3/4);
故答案为:(1/4,3/4,3/4)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目