题目内容
8.设计一个原电池来实现反应:2Fe3++Cu═2Fe2++Cu2+,下列各选项中,电极和电解质溶液选择均正确的是( )| 选项 | 负极材料 | 正极材料 | 电解质溶液 |
| A | Fe | Cu | Fe(NO3)2 |
| B | Cu | Pt | FeCl2 |
| C | Fe | 石墨 | Fe2(SO4)3 |
| D | Cu | 石墨 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、金属铁比金属铜活泼,铁作负极,但铁与Fe(NO3)2不能自发的发生氧化还原反应;
B、铜比钋活泼,金属铜做原电池的负极,但铜与FeCl2不能自发的发生氧化还原反应;
C、碳为非金属,所以金属铁做原电池的负极;
D、碳为非金属,所以金属铜做原电池的负极.
解答 解:A、金属铁比金属铜活泼,铁作负极,但铁与Fe(NO3)2不能自发的发生氧化还原反应,所以不能形成原电池,故A错误;
B、铜比钋活泼,金属铜做原电池的负极,但铜与FeCl2不能自发的发生氧化还原反应,所以不能形成原电池,故B错误;
C、碳为非金属,所以金属铁做原电池的负极,电池反应为:2Fe3++Fe=3Fe2+,故C错误;
D、Cu为负极,发生2Fe3++Cu=2Fe2++Cu2+,故D正确.
故选D.
点评 本体考查原电池的构成条件和原电池的工作原理知识,要求学生熟记教材知识,学以致用.

练习册系列答案
相关题目
18.根据等电子原理,互为等电子体的微粒具有相似的空间构型.下列各组粒子的空间构型不同的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
19.下列实验操作中不正确的是 ( )
| A. | 分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液直接蒸干 | |
| D. | 称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
16.下列实验能达到目的是( )
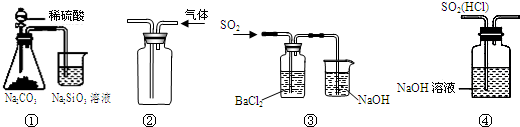

| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②装置收集CO2气体 | |
| C. | 用图③装置制备BaSO3沉淀 | |
| D. | 用图④装置除去SO2中的HCl |
13.下列说法不正确的是( )
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 光化学烟雾是氮氧化物和烃的排放引发的环境污染 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 甲烷与二氧化碳一样,也是一种温室气体 |
20.下列各项中,( )是决定化学反应速率的最主要因素.
| A. | 反应物化学性质 | B. | 温度 | C. | 反应物浓度 | D. | 催化剂 |
17.硼是植物生长发育必需的微量元素之一,硼玻璃纤维用作火箭的防护材料.下列关于硼的叙述正确的是( )
| A. | 它位于元素周期表第二周期第ⅡA族 | B. | 硼酸是弱酸 | ||
| C. | 硼的金属性比铝强 | D. | 硼的原子半径比碳小 |
18.下列事实不能用勒夏特列原理解释的是( )
| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
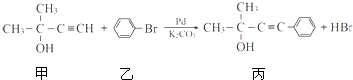
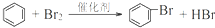 .
.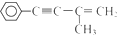 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.