题目内容
【题目】某化学小组在查阅文献及实验探究的基础上,深刻地认识了卤素的性质。
I.F2与C12的相似性。1971年N.H.Studier和E.H.Appelman从冰(-40℃)的氟化作用中首次发现F2、C12与水的反应相似。
(1)写出氟气与水发生上述反应的化学方程式_____________________________________。
II.次氯酸钠和氯酸钾的制备。按图装配仪器并检查装置的气密性。

第一步:在锥形瓶内放约3g MnO2粉末,安全漏斗深入试管底部;
第二步:在管6中放4mL 6mol·L-1KOH溶液(放热水浴中),管7中放4mL 2mol· L-1NaOH溶液(放冰水浴中)。打开控制夹3,关闭控制夹4;
第三步:由漏斗加入15mL 9mol·L-1HC1溶液,缓慢加热,控制氯气均匀产生。热水浴温度控制在323K~328K;
第四步:一段时间后,停止加热,……
(2)锥形瓶中用小试管的优点为_________________________________________________。
(3)停止加热后的操作是____________________________________,再将管6和管7拆下。
(4)查阅文献资料知道,将NaC1O溶液加热,NaC1O分解可生成NaC1O3,据此推断若将KC1O3加热至673K,其分解的化学方程式为_____________________________________。
Ⅲ.C1-、Br-、I-的混合液中C1-的鉴定
已知:Ksp(AgC1)=1.8×10-10 Ksp(AgBr)=5.4×10-13 Ksp(AgI)=8.5×10-17

第一步:取2-3滴C1-、Br-、I-的混合液,加1滴6mol·L-1HNO3溶液酸化,滴加0.1mol·L-1AgNO3溶液至沉淀完全,加热2min,离心分离,弃去溶液:
第二步:在沉淀中加入5~10滴2mol·L-1NH3·H2O溶液,剧烈搅拌,并温热1min,离心沉降,移清液于另一只试管中。
(5)已知![]() ,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(
,设平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溶解AgBr沉淀所需氨水的最低浓度约为_______mol·L-1(![]() )。
)。
(6)根据上述计算,可推知清液中溶质主要成分的化学式为_________________________。
第三步:清液用6mol·L-1HNO3酸化,
(7)现象是_______________________________________________,证实C1-存在。反应的离子方程式为__________________________________________________。
【答案】F2+H2O![]() HFO+HF 节省药品(答“液封”也对) 关闭控制夹3,打开控制夹4 4KClO3
HFO+HF 节省药品(答“液封”也对) 关闭控制夹3,打开控制夹4 4KClO3![]() 3KClO4+KCl 43(或43.2) [Ag(NH3)2] Cl 有白色沉淀生成 [Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+
3KClO4+KCl 43(或43.2) [Ag(NH3)2] Cl 有白色沉淀生成 [Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+
【解析】
根据氯气和水的反应分析氟和水的反应方程式。根据已知信息,温度高时盐会发生歧化反应分析氯酸钾加热条件下生成的产物。根据溶度积的大小分析沉淀和先后顺序和溶解顺。
(1)根据氯气和水反应生成盐酸和次氯酸分析,氟和水的方程式为:F2+H2O![]() HFO+HF;
HFO+HF;
(2)锥形瓶中放置的为二氧化锰,通过长颈漏斗加入浓盐酸,放置一个小试管时,盐酸将小试管充满后才流出,与二氧化锰接触,并且封住长颈漏斗的下端,即液封,不会让氯气从中逸出,这样做节省药品。
(3)停止加入后,装置中仍产生氯气,关闭控制夹3,打开控制夹4,将剩余的氯气通入5中进行吸收,防止污染。
(4)查阅资料得到,溶液在加热过程中发生歧化反应,同理可知,氯酸钾在温度更高的条件下也能分解,生成高氯酸钾和氯化钾,方程式为:4KClO3![]() 3KClO4+KCl;
3KClO4+KCl;
(5)平衡时[Ag(NH3)2]+浓度为0.1mol·L-1,则溴离子浓度也为0.1 mol·L-1,根据c(Ag+)c(Br-)= 5.4×10-13, 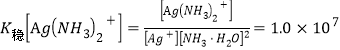 ,分析有
,分析有![]() ,解得NH3·H2O的浓度为43(或43.2)mol/L。
,解得NH3·H2O的浓度为43(或43.2)mol/L。
(6)根据上述计算可知,实验中用于溶解沉淀的氨水的浓度为2mol/L,该浓度远远小于43mol/L,故溴化银不可能溶解。根据溶度积分析,碘化银的溶度积比溴化银更小,故其更不可能溶解,氯化银的溶解度最大,所以在沉淀中加入氨水,只有氯化银溶解,故清液中溶质主要为[Ag(NH3)2] Cl;(7)当清液中加入硝酸时,溶液中有白色沉淀生成,证实有C1-存在,反应的离子方程式为:[Ag(NH3)2]++Cl-+2H+=AgCl+2NH4+.