题目内容
【题目】已知W、X、Y、Z均为中学化学里常见的化学物质,它们之间有如下图所示的转化关系。其中不符合图中转化关系的W、X依次是 ( )

A.W为O2,X为C
B.W为稀HCl,X为NaAlO2溶液
C.W为SO2,X为NaOH溶液
D.W为Cl2,X为Fe
【答案】D
【解析】
试题分析:A、C和过量氧气反应,生成CO2,和少量氧气反应生成CO,CO和氧气反应生成CO2,CO2和C 在高温下生成CO,符合转化关系,故错误;B、少量盐酸,发生:AlO2-+H++H2O=Al(OH)3↓,过量盐酸,发生:AlO2-+4H+=Al3++2H2O,氢氧化铝表现两性氢氧化物,即Al(OH)3+3H+=Al3++3H2O,Al3+和碱反应生成氢氧化铝,符合转化关系,故错误;C、SO2是酸性氧化物,过量NaOH反应:SO2+2NaOH=Na2SO3+H2O,少量NaOH:SO2+NaOH=NaHSO3,Na2SO3+SO2+H2O=2NaHSO3,NaHSO3+NaOH=Na2SO3+H2O,符合转化关系,故错误;D、无论氯气是否过量,生成的都是FeCl3,不符合转化关系,故正确。

 应用题作业本系列答案
应用题作业本系列答案【题目】(15分)I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
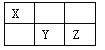
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
温度/℃ | 500 | 700 | 850 | 1 000 |
平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。