题目内容
【题目】(15分)I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
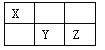
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
温度/℃ | 500 | 700 | 850 | 1 000 |
平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。
【答案】(15分)
(1)第三周期第VIA族 (1分)
(2)酸性:HClO4>H2SO4,或稳定性:HCl>H2S等合理答案 (1分)
(3)< (1分)
NH4++H2O![]() NH3·H2O+H+(3分)
NH3·H2O+H+(3分)
(4)N2H4+4CuO=N2↑+2Cu2O+2H2O (3分)
(5)< (2分)
(6)x<3.0 4.8 mol (各2分,共4分)
【解析】试题分析:(1)根据三种元素在周期表中的位置判断,Y是第三周期元素,所以Y的最外层电子数是6,所以Y为S元素,S位于元素周期表的第三周期第VIA族;则X是N元素,Z是Cl元素。
(2)S与Cl的非金属性的强弱判断,可依据最高价氧化物的水化物的酸性的强弱或气态氢化物的稳定性的强弱来判断,酸性:HClO4>H2SO4,或稳定性:HCl>H2S或氯气能与H2S溶液发生置换反应生成S单质等;
(3)N元素的氢化物是氨气,最高价氧化物的水化物为硝酸,二者反应生成硝酸铵,铵根离子水解使溶液为酸性,pH<7;离子方程式是NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(4)含有18个电子的N的氢化物为N2H4,与该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体氮气,根据元素守恒可知产物中有水生成,所以反应的化学方程式是N2H4+4CuO=N2↑+2Cu2O+2H2O;
(5)CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度升高而减小,说明升高温度,平衡逆向移动,所以正向为放热反应,ΔH<0;
CO2(g)+H2(g)的平衡常数随温度升高而减小,说明升高温度,平衡逆向移动,所以正向为放热反应,ΔH<0;
(6)850 ℃时,反应的平衡常数是1,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若反应正向进行,则浓度商小于1时,该反应的化学方程式中物质的系数均是1,所以浓度商即为物质的量商,则(1.0×x)/(1.0×3.0)<1,解得x<3.0;若x=5.0,则反应逆向进行,设平衡时二氧化碳、氢气的物质的量均减少xmol,则[(1-x)(5-x)]/[(1+x)(3+x)]=1,解得x=2/9mol=0.2mol,所以氢气的物质的量是5mol-0.2mol=4.8mol。