题目内容
【题目】利用海水可以提取溴和镁,提取过程如下。
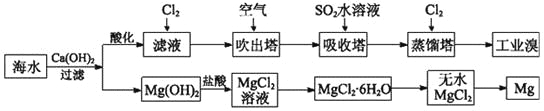
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。
(3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。
【答案】对溴元素进行富集 SO2+Br2+2H2O=4H++2Br-+SO42— 通入空气将溴蒸气带出,使Br2(aq)![]() Br2(g)平衡向右移动 加热浓缩、冷却结晶 179.2
Br2(g)平衡向右移动 加热浓缩、冷却结晶 179.2
【解析】
(1)两次转化过程中,使溴进行富集。
(2)由于得到的是MgCl2·6H2O,所以需要经过加热浓缩、冷却结晶、过滤等步骤,而不能直接将溶液蒸干。
(3)10 m3海水中Br-的质量为104L×64×10-3 g·L-1=640 g,根据Cl2+2Br-=2Cl-+Br2,可知一次转化消耗89.6 L Cl2(标准状况下),两次需要179.2 L Cl2(标准状况下)。

【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
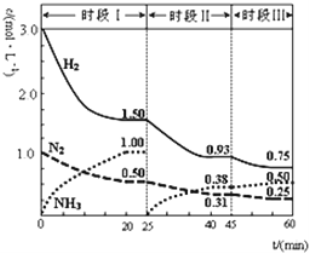
【题目】氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
(1)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,υ(N2O4)=___mol·L1·min1。
②上述反应中,υ正(NO2)=k1·c2(NO2),υ逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为___。改变温度至T1时k1=k2,则T1__373K(填“>”“<”或“=”)。
(2)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
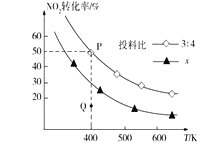
①ΔH___0(填“>”“<”或“=”)。
②x___3∶4(填“>”“<”或“=”)。
③400K时,反应的平衡常数为___(填计算式即可)。
④投料比为3∶4时,Q点υ逆(NH3)___(填“>”“<”或“=”)P点υ逆(NH3)。
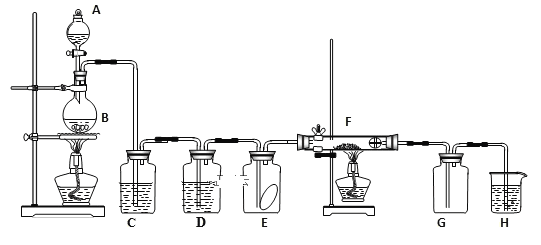
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
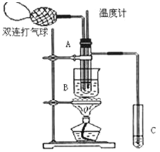
请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在________________________________,目的是________________________;当试管A内的主要反应完成后温度计水银球的位置应在________________,目的是________。
(3)烧杯B的作用是________;烧杯B内盛装的液体可以是________(写出一种即可,在题给物质中找)
(4)写出乙酸和碳酸氢钠反应的离子方程式________________________。