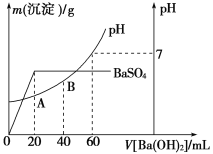
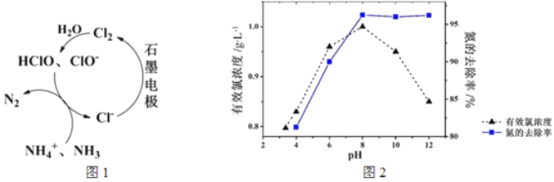
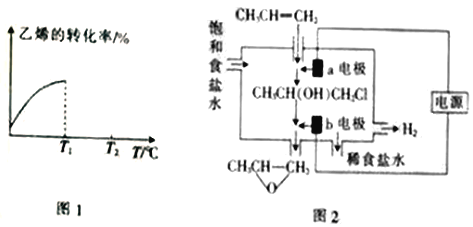
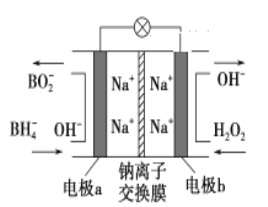
题目内容
【题目】已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2![]() +8H2O,下列说法正确的是 ( )
+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
【答案】B
【解析】
A.由反应方程式可知,氧化产物为Cl2,还原产物为MnCl2,氧化产物与还原产物的物质的量之比为5:2,故A错误;
B.每生成1molCl2时,反应中转移的电子为1mol×2×[0-(-1)]=2mol,故B正确;
C.元素的化合价降低,作氧化剂,高锰酸钾是氧化剂,氯气是氧化产物,所以KMnO4的氧化性强于Cl2的氧化性,故C错误;
D.由方程式可知,每消耗16molHCl,只有10mol失去电子,则其中作还原剂的HCl是10mol,高锰酸钾作氧化剂,氧化剂与还原剂的物质的量之比为2mol:10mol=1:5,故D错误;
故选B。

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目