题目内容
【题目】环氧乙烷(![]() )、环氧丙烷(
)、环氧丙烷(![]() )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①![]()
![]()
②2![]()
![]()
![]()
③![]()
![]()
![]()
![]() _____
_____![]()
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为____,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____(填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____。
③该反应的平衡常数K_____(精确到0.01)。
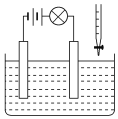
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____。
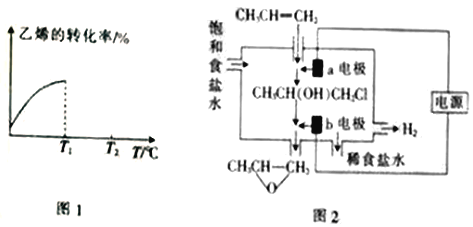
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______。
②b电极区域生成环氧丙烷的化学方程式为______。
【答案】-212 80% 降低温度或增加氧气的浓度等 0.32mol/(L·min) 13.33 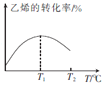 或
或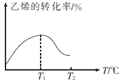 2Cl-―2e-=Cl2↑ CH3CH(OH)CH2Cl+NaOH→
2Cl-―2e-=Cl2↑ CH3CH(OH)CH2Cl+NaOH→![]() +NaCl+H2O
+NaCl+H2O
【解析】
(1)根据盖斯定律分析解答;
(2)根据三段式结合气体总压减少了20%,分析计算出反应的氧气的物质的量,再分析解答;
(3)①根据图示a电极区丙烯与饱和食盐水的电解产物反应,转化为氯丙醇分析解答;②b电极区域氯丙醇[CH3CH(OH)CH2Cl]与氢氧化钠反应生成环氧丙烷,据此书写反应的方程式。
(1)①![]()
![]() ,②2
,②2![]()
![]()
![]() ,根据盖斯定律,将①×2-②得:
,根据盖斯定律,将①×2-②得:![]()
![]()
![]()
![]() 2×(
2×(![]() )-(
)-(![]() )=-212
)=-212![]() ,故答案为:-212;
,故答案为:-212;
(2)设反应的氧气的物质的量为x,则
![]()
![]()
![]()
起始(mol) 1 1 0
反应(mol) 2x x 2x
平衡(mol) 1-2x 1-x 2x
5min后反应达到平衡,气体总压减少了20%,则气体的物质的量减少20%,![]() =20%,解得:x=0.4mol。
=20%,解得:x=0.4mol。
①平衡时CH2=CH2(g)的转化率为![]() ×100%=80%;该反应为气体物质的量减小的放热反应,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施有降低温度或增加氧气的浓度等,故答案为:80%;降低温度或增加氧气的浓度等;
×100%=80%;该反应为气体物质的量减小的放热反应,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施有降低温度或增加氧气的浓度等,故答案为:80%;降低温度或增加氧气的浓度等;
②0~5min内,环氧乙烷的生成速率为 =0.32mol/(L·min),故答案为:0.32mol/(L·min);
=0.32mol/(L·min),故答案为:0.32mol/(L·min);
③该反应的平衡常数K=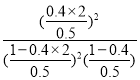 =13.33,故答案为:13.33;
=13.33,故答案为:13.33;
④反应达到平衡后,温度再升高,平衡逆向移动,乙烯的转化率下降,则乙烯的转化率与温度的关系曲线为 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(3)①根据CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl,及a电极区丙烯与饱和食盐水的电解产物反应,转化为氯丙醇,说明a电极区生成了氯气,则a电极为阳极,电极反应式为2Cl-―2e-=Cl2↑,故答案为:2Cl-―2e-=Cl2↑;
②b电极区域氯丙醇[CH3CH(OH)CH2Cl]与氢氧化钠反应生成环氧丙烷的化学方程式为CH3CH(OH)CH2Cl+NaOH→![]() +NaCl+H2O,故答案为:CH3CH(OH)CH2Cl+NaOH→
+NaCl+H2O,故答案为:CH3CH(OH)CH2Cl+NaOH→![]() +NaCl+H2O。
+NaCl+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案