题目内容
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是
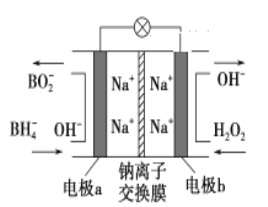
A. 电池工作时Na+从b极区移向a极区
B. a极上的电极反应式为:BH4-+8OH--8e-===BO2-+6H2O
C. 每消耗3 mol H2O2,转移3 mol e-
D. b极上的电极反应式为:H2O2+2e-+2H+===2H2O
【答案】B
【解析】
由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,正极H2O2得电子被还原生成OH-,结合原电池的工作原理分析解答该题。
由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O。正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-。则
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故A错误;
B.反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故B正确;
C.根据b电极反应式H2O2+2e-=2OH-可判断每消耗3molH2O2,转移的电子为6mol,故C错误;
D.b电极为正极,反应式应该为H2O2+2e-=2OH-,故D错误;
故答案选B。

练习册系列答案
相关题目