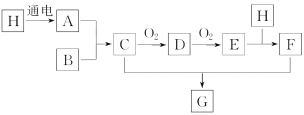
题目内容
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
【答案】氧化 不可行 溴水与乙醛发生取代反应有HBr生成,乙醛被氧化生成乙酸和HBr,溶液均呈酸性 0 a 2a CH3CHO+Br2+H2O=CH3COOH+2H++2Br- 在两支洁净的试管中分别加入2ml新制银氨溶液,各滴入几滴乙醛和乙醇,振荡,水浴加热 滴加乙醛的试管中有银镜生成,而滴加乙醇的试管无现象 乙醛的还原性比乙醇强
【解析】
I(3)根据乙醛中官能团的性质分析;
Ⅱ.(1)根据乙醛与溴水反应的产物分析;
(2)由于乙醛是足量的,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol;
Ⅲ.加入过量AgN03溶液,得到淡黄色沉淀为AgBr,根据质量求出其物质的量,再分析反应;
Ⅳ.乙醛能与银氨溶液发生氧化反应,乙醇不能,依此设计实验。
I(3)乙醛中官能团为CHO,CHO具有还原性,可被氧化,所以可能发生氧化反应;
Ⅱ.(1)方案1中,无论取代(生成HBr)或氧化乙醛(生成CH3COOH),均使反应后溶液显酸性,故不可行;
(2)由于乙醛是足量的,乙醛中官能团为CHO,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol;
Ⅲ![]() 得到固体
得到固体![]() 为AgBr的质量,n(AgBr)=
为AgBr的质量,n(AgBr)=![]() ,n(Br)=2n(Br2),则反应为氧化反应,其离子方程式为:CH3CHO+Br2+H2O=CH3COOH+2H++2Br-;
,n(Br)=2n(Br2),则反应为氧化反应,其离子方程式为:CH3CHO+Br2+H2O=CH3COOH+2H++2Br-;
Ⅳ![]() 乙醛能与银氨溶液发生氧化反应,乙醇不能,依此设计实验;
乙醛能与银氨溶液发生氧化反应,乙醇不能,依此设计实验;
实验操作步骤 | 实验现象 | 结论 |
在两支洁净的试管中分别加入2mL新制银氨溶液,各滴入几滴乙醛和乙醇,振荡,水浴加热 | 滴加乙醛的试管中有银镜生成,而滴加乙醇的试管无现象 | 乙醛的还原性比乙醇强 |
。

 开心快乐假期作业暑假作业西安出版社系列答案
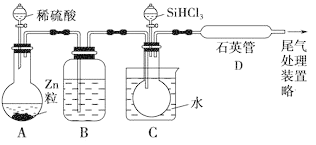
开心快乐假期作业暑假作业西安出版社系列答案【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
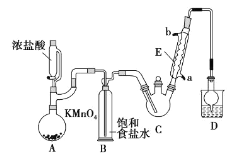
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)仪器E的名称是____,冷凝水的流向是____口进水(填“a”或“b”)。
(2)有同学认为该装置存在一处缺陷,应在BC之间加一干燥装置,理由是____。
(3)该装置C控制反应温度在70℃左右,可采用____加热的方法;
(4)装置D干燥管的作用为____,装置D烧杯中的试剂是____。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是(填名称)____。
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。