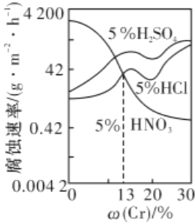
题目内容
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
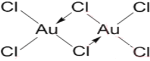
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
【答案】氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低 7 CCl4(或SiF4等) N ![]() >
>  Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
【解析】
(1)氮化硼、氮化铝、氮化镓都是原子晶体,原子半径越小,共价键的键长越短,键能越大,熔点越高;
(2)N有7 个电子,每一个电子运动状态均不同,基态氮原子的核外共有7种不同运动状态的电子,与PO43-互为等电子体的分子有CCl4(或SiF4等).
(3)铬原子有4个能层,K、L、M、N,最高能层符号是N,其价电子轨道表示式为![]() ;
;
(4)Cu失去1个电子后形成3d10的稳定结构,故第二电离能大;
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在,说明它是分子晶体;
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,离子符号为:[Zn(CN)4]2-,Au+与CN-形成的配离子为直线形,离子符号为:[Au(CN)2]-。
(1)由题中信息可知,氮化硼、氮化铝、氮化镓与金刚石类似,都是原子晶体,原子半径B<Al<Ga,键长依次增大,键能依次降低,熔点依次降低;
(2)N有7 个电子,每一个电子运动状态均不同,基态氮原子的核外共有7种不同运动状态的电子,PO43-是5个原子32个电子,与PO43-互为等电子体的分子有CCl4(或SiF4等).
(3)铬原子有4个能层,K、L、M、N,最高能层符号是N,价电子构型3d54s1,其价电子轨道表示式为![]() ;
;
(4)Cu失去1个电子后形成3d10的稳定结构,故第二电离能大。比较第二电离能:Cu>Zn;
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。说明它是分子晶体,Au2Cl6的结构式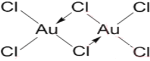 ;
;
(6) Zn2+与CN-形成的配离子为正四面体形,离子符号为:[Zn(CN)4]2-,Au+与CN-形成的配离子为直线形,离子符号为:[Au(CN)2]-, 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式:Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-。

【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
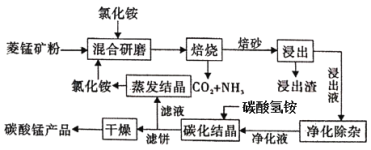
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
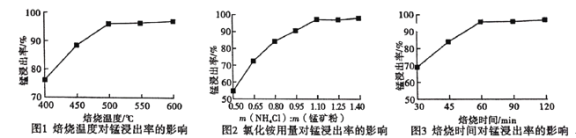
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。