题目内容
【题目】硫化钠是一种重要的化工原料。工业上用硫酸钠来制得硫化钠。制备硫化钠的反应原理为: Na2SO4(s)+4H2(g) ![]() Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为________,若只改变一个影响因素,当平衡移动时,K值________变化(填“一定”或“不一定”);当K值变大时,逆反应速率________.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说活错误的是________。
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe2O3固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.74g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.164g。则10分钟内H2的平均反应速率________。
(4)请写出向Ba(ClO)2溶液中通入足量SO2气体后所发生化学反应的离子方程式____________________________________。
【答案】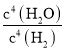 不一定 增大 d 0.0018mol/(Lmin) Ba2++2C1O-+2SO2+2H2O=BaSO4↓+4H++SO42-+2Cl-
不一定 增大 d 0.0018mol/(Lmin) Ba2++2C1O-+2SO2+2H2O=BaSO4↓+4H++SO42-+2Cl-
【解析】
(1)根据反应的平衡常数=![]() 书写;平衡常数只随温度变化;该反应是吸热反应,集合温度对平衡常数的影响判断温度的变化,再判断反应速率的变化;
书写;平衡常数只随温度变化;该反应是吸热反应,集合温度对平衡常数的影响判断温度的变化,再判断反应速率的变化;
(2)该反应是气体体积不变的吸热反应,反应达到平衡状态,正逆反应速率相同时,各组分含量保持不变,变量不变说明反应达到平衡状态;
(3)根据方程式集合差量法计算反应的氢气的物质的量,再求反应速率;
(4)二氧化硫水溶液呈酸性,C1O-在酸性条件下具有强氧化性,可与二氧化硫发生氧化还原反应,以此书写反应的离子方程式。
(1)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),反应的平衡常数表达式K=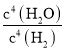 ;影响化学平衡的因素有温度、压强、浓度等,改变一个条件平衡发生移动,但平衡常数只随温度变化,不随压强、浓度的改变,所以若只改变一个影响因素,当平衡移动时,K值不一定变化;该反应的△H>0,是吸热反应,当K值变大时,说明是温度的影响,平衡正向进行,说明是升高温度,平衡正向进行,正、逆反应速率都增大,故答案为:
;影响化学平衡的因素有温度、压强、浓度等,改变一个条件平衡发生移动,但平衡常数只随温度变化,不随压强、浓度的改变,所以若只改变一个影响因素,当平衡移动时,K值不一定变化;该反应的△H>0,是吸热反应,当K值变大时,说明是温度的影响,平衡正向进行,说明是升高温度,平衡正向进行,正、逆反应速率都增大,故答案为: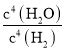 ;不一定;增大;
;不一定;增大;
(2)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),该反应是气体体积不变的吸热反应。a.反应前后气体体积不变,反应过程中容器内压强始终保持不变,故a正确;b.反应达到平衡状态,物质的量不变,氢气和水蒸汽的物质的量之比保持不变,故b正确;c.加入少量Fe2O3固体,高温时,氧化铁能够与氢气反应生成水蒸气,氢气浓度减小,水蒸气浓度增大,平衡逆向移动,故c正确;d.移除部分Na2S固体,平衡不发生移动,故d错误;故答案为:d;
(3)设反应消耗的氢气为nmol,
Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g) △m(s)
4mol 64 g
n (2.74-2.164)g
![]() =
=![]() ,解得n=0.036mol,则该时间范围内的平均反应速率v(H2)=
,解得n=0.036mol,则该时间范围内的平均反应速率v(H2)= ═0.0018mol/(L·min),故答案为:0.0018mol/(Lmin);
═0.0018mol/(L·min),故答案为:0.0018mol/(Lmin);
(4) Ba(C1O)2溶液具有强氧化性,二氧化硫具有还原性,往Ba(C1O)2溶液中通入足量SO2气体发生氧化还原反应,Ba(C1O)2+2SO2+2H2O=BaSO4↓+H2SO4+2HCl,反应的离子方程式为Ba2++2C1O-+2SO2+2H2O=BaSO4↓+4H++SO42-+2Cl-,故答案为:Ba2++2C1O-+2SO2+2H2O=BaSO4↓+4H++SO42-+2Cl-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案