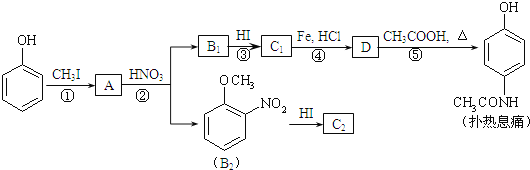
题目内容
【题目】工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:

【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
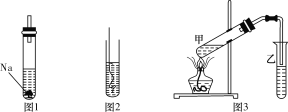
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。
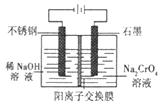
①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
【答案】过滤碱4Cr(OH)3+ 4 Na2CO3+ 3O2![]() 4Na2CrO4+4CO2+6H2OAlO2–+H++ H2O
4Na2CrO4+4CO2+6H2OAlO2–+H++ H2O![]() Al(OH)3↓蒸发浓缩促使反应2CrO42-+2H+
Al(OH)3↓蒸发浓缩促使反应2CrO42-+2H+![]() Cr2O72-+H2O平衡向正方向移动2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑)2-d
Cr2O72-+H2O平衡向正方向移动2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑)2-d
【解析】分析:(1)本题主要考查物质分离的方法,从盐类水解的规律角度解答;
(2)根据氧化还原反应的规律,氧化焙烧过程中铬元素化合价升高,所以一定有氧气参加反应,结合质量守恒定律完成方程式;
(3)根据流程图,水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质,加入硫酸调节溶液的pH可得到硫酸钠和Na2Cr2O7溶液,所以还应该生成Zn(OH)2、Al(OH)3沉淀;
(4)根据已知条件,加入硫酸发生CrO42-+2H+Cr2O72-+H2O,从平衡移动的角度分析;
(5)根据电解原理,阴极得电子发生还原反应。
解答:(1)操作①是从溶液中分离出滤渣,属于固液分离,操作①是的名称是过滤;水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等都为强碱弱酸盐,水解后呈碱性;
(2)氧化焙烧过程中有氧气参加反应,根据质量守恒可知还应生成水,反应的方程式为4Cr(OH)3+ 4 Na2CO3+ 3O2![]() 4Na2CrO4+4CO2+6H2O
4Na2CrO4+4CO2+6H2O
(3)Zn(OH)2、Al(OH)3具有两性,水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀,NaAlO2加入酸生成Al(OH)3沉淀的离子方程式为AlO2–+H++ H2O![]() Al(OH)3↓;(4)水浸后溶液中存在Na2CrO4,加入硫酸发生CrO42-+2H+Cr2O72-+H2O,加入硫酸可使平衡向正反应方向移动,将溶液蒸发浓缩、冷却结晶可得到晶体,(5)以铬酸钠为原料,电化学法制备重铬酸钠,阴极发生还原反应,电极反应为2H2O+2e-=2OH-+H2↑,
Al(OH)3↓;(4)水浸后溶液中存在Na2CrO4,加入硫酸发生CrO42-+2H+Cr2O72-+H2O,加入硫酸可使平衡向正反应方向移动,将溶液蒸发浓缩、冷却结晶可得到晶体,(5)以铬酸钠为原料,电化学法制备重铬酸钠,阴极发生还原反应,电极反应为2H2O+2e-=2OH-+H2↑,
根据铬元素守恒,设开始Na2CrO4的物质的量为a mol,生成Na2Cr2O7的物质的量为x mol
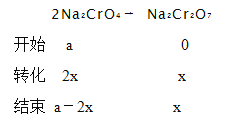
反应结束钠元素的物质的量为2(a-2x)+2x,铬元素的物质的量为(a-2x)+2x,则![]() = d;x=
= d;x=![]() ,所以铬酸钠的转化率为
,所以铬酸钠的转化率为![]() = 2-d。
= 2-d。