题目内容
【题目】按要求完成下列各题:
(1)粘土[主要成分Al2Si2O5(OH)4] 是制备陶瓷的原料,请以氧化物形式表示粘土的组成_____________。
(2)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为_________________________。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀,这一过程中发生反应的化学方程式为_______。
(4)明矾可用于净水,请说明原因________________________。
(5)下图,若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在, B是白色胶状沉淀。
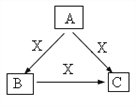
①实验室中常用A与某种溶液反应制备B,请写出该反应的离子方程式 _________________。
②A与C也可以反应生成B,请写出反应的离子方程式___________________。
【答案】 Al2O3·2SiO2·2H2O 3SiCl4+2N2+6H2=Si3N4+12HCl SiO2+4HF=SiF4↑+2H2O 明矾溶于水产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体有较大的吸附面积,可以吸附水中悬浮的杂质,使杂质沉降 3NH3H2O +Al3+=Al(OH)3↓+3NH4+ Al3++3 [Al(OH)4]- =4Al(OH)3↓
【解析】(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序可知,[Al2Si2O5(OH)4]可改成Al2O32SiO22H2O;
(2)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,同时生成氯化氢气体,其反应的化学方程式为:3SiCl4+2N2+6H2=Si3N4+12HCl;
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀,这一过程中发生反应为氢氟酸与玻璃中的二氧化硅反应生成四氯化硅和水,其化学方程式为SiO2+4HF=SiF4↑+2H2O;
(4)明矾净水是因为明矾溶于水产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体有较大的吸附面积,可以吸附水中悬浮的杂质,使杂质沉降;
(5)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在, B是白色胶状沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有[Al(OH)4]-,X为氢氧化钠。故①A与某种溶液(可以选择弱碱氨水)反应制备B反应的离子方程式为:3NH3H2O +Al3+=Al(OH)3↓+3NH4+;②A与C也可以反应生成B,其反应的离子方程式为:Al3++3 [Al(OH)4]- =4Al(OH)3↓。

 高中必刷题系列答案
高中必刷题系列答案