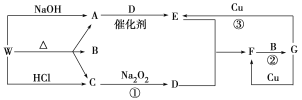
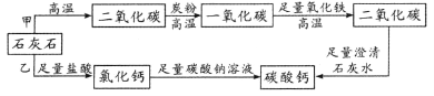
题目内容
【题目】有资料认为NO、NO2不能与Na2O2反应。某小组学生提出质疑,从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出假设并进行探究:
假设Ⅰ.Na2O2能氧化NO2
假设Ⅱ.NO2能氧化Na2O2
(1)小组甲同学设计了如图实验装置,并进行如下实验:
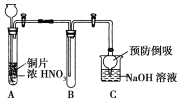
①试管A中发生反应的化学方程式是______________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带余烬的木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是______________________________。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;但带余烬的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是
_____________________________________________________________________。
(2)丙同学认为NO易被O2氧化,更易被Na2O2氧化。
查阅资料:①2NO+Na2O2===2NaNO2
②6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O
③酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
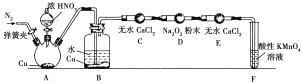
①A装置中盛装Cu片的仪器名称是__________,B中观察到的主要现象是______________________,F装置的作用是______________________________。
②在反应前,打开弹簧夹,通入一段时间N2,目的是______________________________。
③充分反应后,检验D装置中产物是NaNO2还是NaNO3的实验方法是____________________________________________________________________________。
【答案】
(1)①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ②除去生成NO2气体中混有的水蒸气③Na2O2+2NO2=2NaNO3
(2)①三颈烧瓶 铜片逐渐溶解,溶液变为蓝色,有无色气泡产生 吸收未反应的NO ②排出装置中的空气 ③取D装置中产物少许于试管,加入足量稀盐酸,若产生无色气体,且遇到空气变为红棕色,产物是亚硝酸钠;反之为硝酸钠
【解析】
试题分析:(1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②由于生成的NO2中含有水蒸气,水蒸气与过氧化钠反应也产生氧气,因此不能达到实验目的,为达到实验目的,需要在A、B之间增加一个除去生成NO2气体中混有的水蒸气装置;
③观察到红棕色气体迅速消失,说明二氧化氮能与过氧化钠反应,但带余烬的木条未复燃,说明没有产生氧气,则NO2和Na2O2反应的化学方程式是Na2O2+2NO2=2NaNO3;
(2)①根据装置的构造可判断A装置中盛装Cu片的仪器名称为三颈烧瓶;在B装置中二氧化氮与水反应生成稀硝酸,稀硝酸与Cu反应生成NO,所以B中观察到的主要现象是:铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;NO有毒,需要尾气处理,酸性高锰酸钾溶液能把NO氧化,因此F装置的作用是吸收未反应的NO。
②空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;
③亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:
取D装置中产物少许于试管,加入足量稀盐酸,若产生无色气体,且遇到空气变为红棕色,产物是亚硝酸钠;反之为硝酸钠。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围? 。
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100 mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O/span>;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计算过程)
【题目】有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是______(填编号)。
A.可能互为同系物 |
B.在空气中燃烧时火焰明亮且产生黑烟 |
C.一定能使高锰酸钾酸性溶液褪色 |
D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式__________,它的一氯代物的同分异构体有________种。
(3)写出除苯外分子式为C6H6且结构中只有C—C键和C—H键的有机物的结构简式:____________________________________________________________。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使高锰酸钾酸性溶液和溴水褪色,则该有机物的结构简式为________,写出其发生加聚反应的化学方程式:____________________________________。