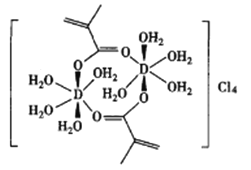
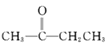题目内容
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:![]() 不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是
不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 1 | 1 | 2 |
反应物起始量 | 2mol | 2mol | 2mol |
温度 |
|
|
|
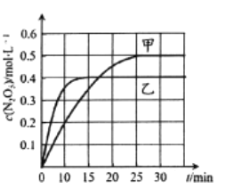
A.![]() 内甲容器中反应的平均速率:
内甲容器中反应的平均速率:![]()
B.![]() ,
,
C.平衡时![]() 浓度:
浓度:![]()
D.![]() 时,若起始时间向容器甲中充入
时,若起始时间向容器甲中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则脱硝反应达到平衡前,
,则脱硝反应达到平衡前,![]() 正
正![]() 逆
逆![]()
【答案】D
【解析】
A.图象分析可知,![]() 生成浓度
生成浓度![]() ,则消耗
,则消耗![]() 浓度
浓度![]() ,根据
,根据![]() 计算
计算![]() ;
;
B.由图象分析,先拐先平数值大,则乙的温度较高,![]() ,温度越高
,温度越高![]() 浓度越小,说明反应逆向移动,正反应是放热反应;
浓度越小,说明反应逆向移动,正反应是放热反应;
C.若丙加入2molN2O5、2molO2,则丙与乙为等效平衡,现丙少加入了1molO2,平衡右移,导致c(N2O5)增大;
D.若起始时向容器甲中充入![]() 、
、![]() 、
、![]() 和2mol
和2mol![]() ,计算浓度商Qc和平衡常数比较判断反应进行的方向。
,计算浓度商Qc和平衡常数比较判断反应进行的方向。
A.由图,![]() 内甲容器中
内甲容器中![]() 的浓度变化量为
的浓度变化量为![]() ,
,![]() 十
十![]() ,则消耗
,则消耗![]() 浓度
浓度![]() ,反应速率
,反应速率![]() ,故A错误;
,故A错误;
B.由图象可知,乙先达到平衡,平衡后![]() 浓度比甲小,根据先拐先平数值大,则乙的温度较高,
浓度比甲小,根据先拐先平数值大,则乙的温度较高,![]() ,平衡逆向移动,即正反应是放热反应,
,平衡逆向移动,即正反应是放热反应,![]() ;故B错误;
;故B错误;
C.乙中相当于加入1molN2O5,1molO2,丙容器体积是乙容器的2倍,若丙加入2molN2O5、2molO2,则丙与乙为等效平衡,现丙少加入了1molO2,平衡右移,导致c(N2O5)增大,则平衡时N2O5浓度:![]() ,故C错误;
,故C错误;
D.若起始时向容器甲中充入![]() 、
、![]() 、
、![]() 和2mol
和2mol![]() ,计算浓度商
,计算浓度商![]() 相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,
相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,![]() 正
正![]() 逆
逆![]() ,故D正确;
,故D正确;
故答案选D。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。
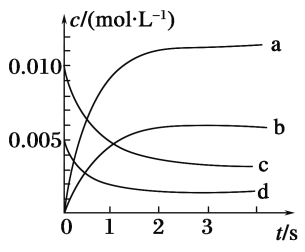
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变