题目内容
【题目】Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为________(只填化学式)。
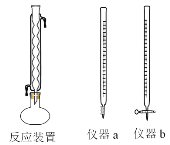
(2)操作Ⅲ的名称是________,所需用到的仪器主要有铁架台、酒精灯、铁圈、玻璃棒__________(填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示)_________________________
Ⅱ.一份无色溶液中可能含有Na+、Fe3+、H+、Mg2+、CO32-、OH-、HCO3-、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①向溶液中滴加酚酞试液,溶液显红色:
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是______________,一定不能大量存在的离子是_______________。
(5)经过上述操作后,还不能肯定是否存在的离子是________。对可能含有的离子,如何进行实验以进一步检验____________________________。
【答案】Ca(OH)2、BaCl2、Na2CO3 蒸发结晶 蒸发皿 H+ + OH- = H2O、CO+2H=HO+CO↑ Na+、CO32-、OH- Fe3+、H+、Mg2+、HCO3-、SO42- Cl- 先加稀硝酸酸化,无现象,再加硝酸银溶液,产生白色沉淀,即有氯离子,反之则无
【解析】
Ⅰ.向粗盐中加水,加热促进其溶解,加入过量的Ca(OH)2溶液,将所有Mg2+完全沉淀,再加入过量BaCl2溶液可将粗盐中的SO42-完全沉淀,最后加入饱和Na2CO3溶液将溶液中的Ca2+和Ba2+完全除去,过滤后的滤液中含有过量的碳酸钠和NaCl,此时加入一定量的盐酸,可除去碳酸钠,最后蒸发结晶即可得到氯化钠晶体,据此分析作答
Ⅱ.溶液为无色透明,有色离子不能存在,因此溶液中一定不存在Fe3+;向溶液中滴加酚酞试液,溶液显红色,说明溶液显碱性,存在OH-,而OH-与H+、Mg2+、HCO3-不能共存,因此溶液中一定不存在H+、Mg2+和HCO3-;取2mL溶液,先加足量稀硝酸酸化,有气体产生,说明溶液中存在CO32-,再加氯化钡溶液进行检验,没有明显现象,说明溶液中没有SO42-,溶液中阴阳离子电荷要守恒,因此溶液中规定共存在Na+,据此分析填空;
Ⅰ.(1)由分析可知欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,加入的试剂的顺序为Ca(OH)2、BaCl2、Na2CO3;
(2)操作Ⅲ的名称是蒸发结晶,所需用到的仪器主要有铁架台、酒精灯、铁圈、玻璃棒和蒸发皿;
(3)过滤后加入盐酸,可除去过量的OH-和CO32-,离子方程式为:H+ + OH- = H2O、CO+2H=HO+CO↑。
(4)根据分析可知,溶液中一定存在Na+、CO32-、OH-;一定不存在Fe3+、H+、Mg2+、HCO3-、SO42-;
(5)经过上述操作后,还不能肯定是否存在的离子是Cl-;为了检验Cl-是否存在,可先加稀硝酸酸化,无现象,再加硝酸银溶液,产生白色沉淀,即有氯离子.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案