题目内容
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要合氯消毒剂和漂白剂亚氯酸钠(NaClO2),工艺流程如下:
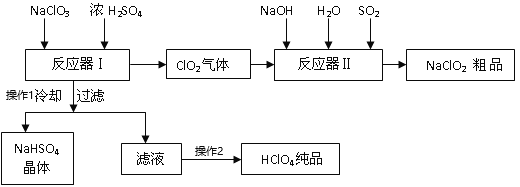
已知:a. NaHSO4的溶解度随着温度的升高而增大,适当条件下可结晶析出;
b.高氯酸是至今为止人们已知酸中的最强酸,沸点:90℃。
(1)操作①冷却过滤的目的是__________________
(2)反应器I中发生化学反应的方程式是_________________,反应器I中的温度最佳为__________(填序号);操作②的名称为______________。
A.0℃ B. 20℃ C. 80℃ D. 120℃
(3)反应器II中发生反应的离子方程式为_________;SO2的作用为_______________(氧化剂、还原剂)。
(4)加快反应器II中反应速率的措施有___________(写出2种措施即可)等。从反应器II中获得NaClO2粗品的实验操作依次是______________(选序号,下同),进一步提纯的操作名称为______________
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶
【答案】降低NaHSO4的溶解度,使NaHSO4结晶析出 3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O C 蒸馏 2ClO2+SO2+4OH=2ClO2-+SO42+2H2O 还原剂 适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积(写出两条即可) DFA B
【解析】
NaClO3和浓H2SO4在反应器I中反应:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O,生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应2ClO2+SO2+4NaOH═2NaClO2+Na2SO4+2H2O,生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4,据此分析。
(1)已知:NaHSO4的溶解度随着温度的升高而增大,故用冷却过滤的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出;
故答案为:降低NaHSO4的溶解度,使NaHSO4结晶析出;
(2)由图可知,NaClO3和浓H2SO4在反应器I中反应,生成物有HClO4、ClO2、NaHSO4等,根据原子守恒、化合价升降守恒配平其方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;反应器I中加入的氯酸钠在浓硫酸的作用下发生了氧化还原反应,得到ClO2气体和高氯酸,所以要得到较高浓度的高氯酸溶液,应该尽可能的升温使ClO2气体溢出,同时温度不能过高,超过高氯酸沸点温度90℃容易使高氯酸气化,所以最佳温度应该选C,80℃;而在后一阶段的滤液中再获得纯净的高氯酸产品,可以选择蒸馏,升高温度至高氯酸沸点温度,蒸馏得到高氯酸纯品;
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;C;蒸馏;
(3)从反应II的前后反应物和产物可以看出,发生了氧化还原反应,ClO2气体做氧化剂,SO2做还原剂在反应中被氧化为了SO42,有碱参与反应生成盐和水,反应的离子方程式为2ClO2+SO2+4OH=2ClO2-+SO42+2H2O;
故答案为:2ClO2+SO2+4OH=2ClO2-+SO42+2H2O;还原剂;
(4)影响反化学应速率的因素有温度、浓度、接触面积等,所以在反应器II中要加快反应速率,可以通过适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等措施来改变;若要从从反应器II中获得NaClO2晶体粗品,可以通过蒸发浓缩、冷却结晶、过滤的方法得到,故选DFA;进一步提纯粗品晶体,则应该对该粗产品进行重结晶处理;
故答案为:适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积等;DFA;B;
故答案为:适当升高温度、或增大氢氧化钠的浓度、气体与溶液的接触面积(写出两条即可);DFA;B。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案