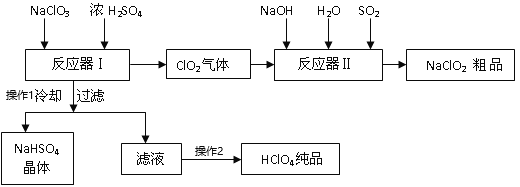
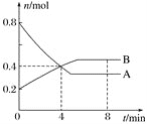
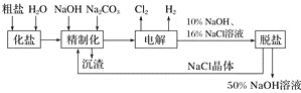
题目内容
【题目】实验室中现用Fe与盐酸反应制取22.4L H2(标准状况下)。
(1)消耗Fe的物质的量为________
(2)如果选用所贴标签为2.0molL-1的盐酸,至少需该盐酸________升?
【答案】0.1mol 0.1L
【解析】
反应:Fe+2HCl=FeCl2+H2↑,根据n=V÷Vm计算氢气物质的量,根据方程式计算消耗Fe、HCl的物质的量,再根据V=n÷c计算需要盐酸体积。
标况下2.24L氢气物质的量为![]() =0.1mol,
=0.1mol,
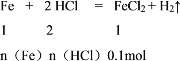
所以n(Fe)=![]() =0.1mol
=0.1mol
n(HCl)=![]() =0.2mol
=0.2mol
需要2.0mol·L-1的盐酸体积为![]() =0.2L,
=0.2L,
答:(1)消耗Fe的物质的量为0.1mol;
(2)消耗2.0mol·L-1的盐酸体积至少为0.1L。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置中提供的物质完成相关实验,最合理的选项是( )
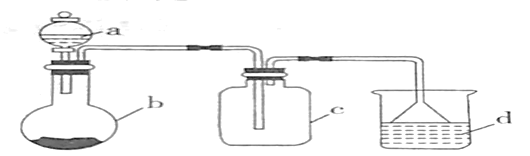
选项 | a中的溶液 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 生石灰 | NH3 | H2O |
B | 浓硝酸 | 铜片 | NO2 | H2O |
C | 稀硝酸 | 铜片 | NO | NaOH溶液 |
D | 浓硫酸 | 亚硫酸钠 | SO2 | NaOH溶液 |
A.AB.BC.CD.D