题目内容
【题目】金属磷化物(如璘化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下
(资料查阅)磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
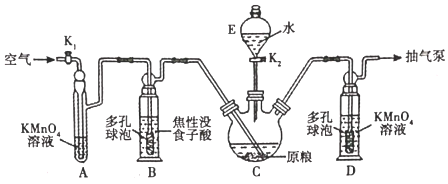
(用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5molL-1KMnO4溶液(H2SO4酸化)。
(操作流程)安装仪器并检査气密性→PH、的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)仪器E的名称是______;仪器B、D中进气管下端设计成多孔球泡形状,目的是______。
(2)A装置的作用是______;B装置的作用是吸收空气中的O2,防止______。
(3)下列操作中,不利于精确測定出实验结果的是______(选填序号)。
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)弹化锌发生水解反应时除产生PH3外,还生成______(填化学式)。
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为______。
(6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用5.0×10-5molL-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为______mgkg-1,该原粮质量______(填“达标”或“不达标“)。
【答案】分液漏斗 增大接触面积 吸收空气中的还原性气体 PH3被氧化 c Zn(OH)2 5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O 0.085 不达标
【解析】
由实验装置图可知,实验的流程为安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。已知C中盛有100g原粮,E中盛有20.00mL1.13×10-3molL-1KMnO4溶液(H2SO4酸化),吸收生成的PH3,B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3,A中盛装KMnO4溶液的作用除去空气中的还原性气体。
(1)仪器E的名称是分液漏斗;仪器B、D中进气管下端设计成多孔球泡形状,目的是增大接触面积,故答案为:分液漏斗;增大接触面积;
(2)A装置的作用是吸收空气中的还原性气体;B装置的作用是吸收空气中的O2,防止PH3被氧化,故答案为:吸收空气中的还原性气体;PH3被氧化;
(3)实验前,将C中原粮预先磨碎成粉末及将蒸馏水预先煮沸、迅速冷却并注入E中,均可准确测定含量,只有实验过程中,用抽气泵尽可能加快抽气速率,导致气体来不及反应,测定不准确,故答案为:c;
(4)磷化锌易水解产生PH3,还生成Zn(OH)2,故答案为:Zn(OH)2;
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O,故答案为:5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O;
(6)由2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O,剩余高锰酸钾为5.0×10-5molL-1×0.01L×![]() ×
×![]() =2×10-6mol,由5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O可知,PH3的物质的量为(0.04L×6.0×10-5molL-1-2×10-6mol)×
=2×10-6mol,由5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O可知,PH3的物质的量为(0.04L×6.0×10-5molL-1-2×10-6mol)×![]() =2.5×10-7mol,该原粮中磷化物(以PH3计)的含量为
=2.5×10-7mol,该原粮中磷化物(以PH3计)的含量为![]() =0.08 mg/kg>0.050mg/kg,则不达标,故答案为:0.085;不达标。
=0.08 mg/kg>0.050mg/kg,则不达标,故答案为:0.085;不达标。

 阅读快车系列答案
阅读快车系列答案【题目】研究铜和铁与浓硫酸的反应,实验如下:
① | ② |
| |
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
下列说法正确的是
A. 常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B. ②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C. 依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D. ①②中现象的差异仅是由于温度改变了化学反应速率