题目内容
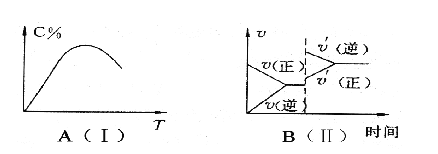
【题目】如图(Ⅰ)表示反应:mA(g)+nB(g) ![]() pC(g)+qD(g);△H。在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变影响平衡的另一个条件,重新建立平衡的反应过程。由此可判断该反应中
pC(g)+qD(g);△H。在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变影响平衡的另一个条件,重新建立平衡的反应过程。由此可判断该反应中
A. m+n>p+q, ![]() <0
<0
B. m+n>p+q, ![]() >0
>0
C. m+n<p+q, ![]() >0
>0
D. m+n<p+q, ![]() <0
<0
【答案】D
【解析】根据图1可知,在最高点之前是建立平衡的曲线,在最高点之后是平衡受温度影响的曲线,可以看出,温度越高C的质量分数越小,说明平衡逆向移动,说明该反应的正反应是放热反应,即![]() <0,在图Ⅱ中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时逆反应速率大于正反应速率,说明平衡逆向移动,由此可确定该反应的正反应是气体体积增大的反应,即m+n<p+q。
<0,在图Ⅱ中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时逆反应速率大于正反应速率,说明平衡逆向移动,由此可确定该反应的正反应是气体体积增大的反应,即m+n<p+q。
故选D。

练习册系列答案
相关题目