题目内容
11.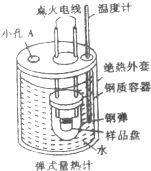 “弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
“弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:(1)小孔A中插入的仪器是环形玻璃搅拌棒.
(2)“弹式量热计”若无绝热外套,则测得的燃烧热数值比实际数值偏小(填“偏大”或“偏小”).
(3)某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 28.3 |
| ② | 24.7 | 28.2 |
| ③ | 24.9 | 28.4 |
②写出能表示硫燃烧热的热化学方程式:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol.
分析 通过图的分析可知,本实验是通过1.6g硫在足量氧气中燃烧放出的热量对水加热,通过测量反应前后水温的变化来计算出反应放出的热量.
(1)小孔A中插入的仪器的作用是使水受热均匀;
(2)“弹式量热计”若无绝热外套,则会导致热量的损失,据此分析燃烧热的数值的变化;
(3)①由实验①②③可知,三次实验的温度差△T均为3.5℃,从而根据热量Q=cm△T即可求出燃烧放出的热量;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.
解答 解:通过图的分析可知,本实验是通过1.6g硫在足量氧气中燃烧放出的热量对水加热,通过测量反应前后水温的变化来计算出反应放出的热量.
(1)小孔A中插入的仪器的作用是使水受热均匀,故应用环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)“弹式量热计”若无绝热外套,则会导致热量的损失,即会测得1.6g硫燃烧时放出的热量偏少,即据此计算出的硫的燃烧热的数值偏小,故答案为:偏小;
(3)①由实验①②③可知,三次实验的温度差△T均为3.5℃,即温度的平均变化值为3.5℃,而热量Q=cm△T=4.18J•g-1•℃-1×1000g×3.5℃=14630J=14.63KJ,故答案为:14.63KJ;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.由于1.6g硫的物质的量n=$\frac{1.6g}{32g/mol}$=0.05mol,燃烧放出14.63KJ的热量,则硫的燃烧热为$\frac{14.63KJ}{0.05mol}$=292.6KJ/mol,故硫的燃烧热的热化学方程式为:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol.
点评 本题考查了燃烧热的测定实验,应注意的是燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,书写燃烧热的热化学方程式时,要使可燃物的计量数为1.

 小学能力测试卷系列答案
小学能力测试卷系列答案
下列说法正确的是( )
| A. | 有机物A属于醛类 | B. | 有机物A与B属于同系物 | ||
| C. | 有机物C能与H2发生加成反应 | D. | 有机物D的一氯代物有2种 |
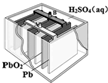
| A. | F | B. | O | C. | Mg | D. | Al |



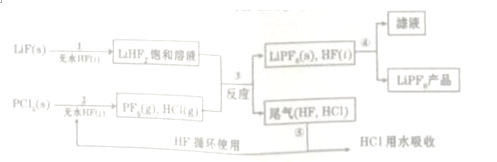
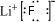 ,无水HF的作用是反应物和溶剂
,无水HF的作用是反应物和溶剂