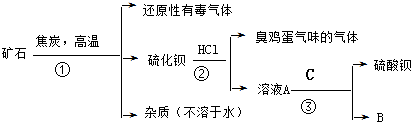
题目内容
10.锂离子电池是一种充电电池,它主要依靠锂离子在正极和负极之间移动来工作,是现代高性能电池的代表,已被广泛用作便携式电源,LiPF6是锂离子电池中广泛应用的电解质,某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下: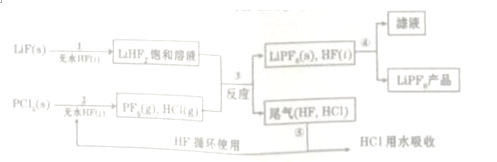
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃
(1)第①步反应中LiF的电子式是
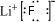 ,无水HF的作用是反应物和溶剂
,无水HF的作用是反应物和溶剂(2)第③步反应中PF5极易水解,其产物为两种酸,写出PF5与过量NaOH水溶液反应的化学方程式PF5+8aOH=Na3PO4+5NaF+4H2O
(3)第⑤步分离尾气中HF、HCl需要将冷凝温度T控制在-85.0°C<T<19.5°C(填写温度范围)HF的沸点比HCl的沸点高的原因是HF分子中存在氢键,HCl分子间是范德华力
(4)LiPF6产品中通常混有少量LiF杂质,取样品xg,测得Li的物质的量为ymol,则该样品中LiPF6的质量分数为$\frac{76(x-26y)}{63x}$×100%(用含有x、y的代数式表示)
分析 (1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,所以无水HF的作用是反应物和溶剂,氟化锂属于离子化合物;
(2)根据元素组成可知,两种酸分别是H3PO4和HF;
(3)分离尾气中HF、HCl需要依据物质沸点分析,HCl分子间存在范德华力,HF分子间含有氢键,沸点大于HCl,可采用冷凝法分离;
(4)根据Li守恒和质量守恒计算得到LiPF6的物质的量,质量分数=$\frac{LiP{F}_{6}质量}{样品质量}$×100%.
解答 解:(1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,所以无水HF的作用是反应物和溶剂,氟化锂属于离子化合物,第①步反应中LiF的电子式是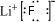 ,
,
故答案为: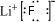 ;反应物和溶剂;
;反应物和溶剂;
(2)根据题目中的信息“PF5极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是H3PO4和HF,所以反应的方程式为PF5+4H2O═H3PO4+5HF,PF5与过量NaOH水溶液反应的化学方程式为:PF5+8aOH=Na3PO4+5NaF+4H2O
故答案为:PF5+8aOH=Na3PO4+5NaF+4H2O;
(3)HCl的沸点是-85.0℃,HF的沸点是19.5℃,第⑤步分离尾气中HF、HCl需要将冷凝温度T控制在-85.0°C<T<19.5°C,HF的沸点比HCl的沸点高的原因是HF分子中存在氢键,HCl分子间是范德华力,
故答案为:-85.0°C<T<19.5°C;HF分子中存在氢键,HCl分子间是范德华力;
(4)设LiPF6为mmol,LiF为nmol;根据Li守恒,有m+n=y,根据质量守恒有152m+26n=x,解得m=$\frac{(x-26y)}{126}$mol,该样品中LiPF6的质量分数=$\frac{(x-26y)×152}{126x}$×100%=$\frac{76(x-26y)}{63x}$×100%,
故答案为:=$\frac{76(x-26y)}{63x}$×100%.
点评 本题为无机化学流程题,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,涉及物质推断、分离提纯、方程式书写、化学计算等知识,注意题干所给信息的使用,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 钠熔成小球并在液面上游动 | B. | 溶液底部有银白色物质生成 | ||
| C. | 有气体生成 | D. | 溶液变浑浊 |
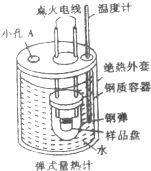 “弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
“弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:(1)小孔A中插入的仪器是环形玻璃搅拌棒.
(2)“弹式量热计”若无绝热外套,则测得的燃烧热数值比实际数值偏小(填“偏大”或“偏小”).
(3)某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 28.3 |
| ② | 24.7 | 28.2 |
| ③ | 24.9 | 28.4 |
②写出能表示硫燃烧热的热化学方程式:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol.
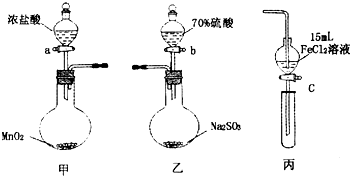 为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).实验步骤:
Ⅰ在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接.
Ⅱ当丙装置中FeC12溶液变黄时,停止加热.
Ⅲ打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
Ⅳ在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止.
Ⅴ更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子.
回答下列问题:
(1)甲中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%的H2SO4比98%的H2SO4电离程度大,溶液中H+浓度大,反应速度快.
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
(5)若要用以上甲和丙装置证明氧化性为:Cl2>Fe3+>I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4.
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化.
③如果观察到丙中溶液下层(CCl4层)先由无色变为紫红色;后看到上层溶液由浅绿色变为红色则结论正确.
④停止通入Cl2.
| A. | Mg2+/Mg | B. | K+/S2- | C. | N/P | D. | Cl-/Cl |
(1)向两种溶液中加入少量稀硫酸并加热,再加氢氧化钠溶液中和硫酸,最后加入银氨溶液微热;
(2)测溶液导电性;
(3)将溶液与溴水混合,振荡;
(4)用舌头尝味道.
其中在实验室进行鉴别的正确方法是( )
| A. | (1)(2) | B. | (1)(3) | C. | (2)(3) | D. | (1)(2)(3)(4) |