题目内容
11.下列元素中原子半径最大的是( )| A. | F | B. | O | C. | Mg | D. | Al |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,据此判断.
解答 解:同周期自左而右原子半径减小,故原子半径:B>O>F,Mg>Al,同主族自上而下原子半径增大,Al>B,故原子半径Mg>Al>O>F,故选C.
点评 本题考查原子半径比较,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.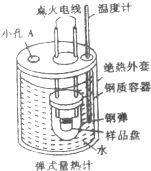 “弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
“弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
(1)小孔A中插入的仪器是环形玻璃搅拌棒.
(2)“弹式量热计”若无绝热外套,则测得的燃烧热数值比实际数值偏小(填“偏大”或“偏小”).
(3)某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):
①1.6g硫完全燃烧放出的热量为14.63KJ.
②写出能表示硫燃烧热的热化学方程式:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol.
 “弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:
“弹式量热计”(如图所示)可以用来测量硫的燃烧热,实验过程如下:样品盘中加入1.6g硫,钢弹中充入足量的氧气,用电灭花引燃反应,测定小孔反应前后容器中水的温度变化,回答下列间题:(1)小孔A中插入的仪器是环形玻璃搅拌棒.
(2)“弹式量热计”若无绝热外套,则测得的燃烧热数值比实际数值偏小(填“偏大”或“偏小”).
(3)某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 28.3 |
| ② | 24.7 | 28.2 |
| ③ | 24.9 | 28.4 |
②写出能表示硫燃烧热的热化学方程式:S(s)+O2(g)=SO2(g)△H=-292.6KJ/mol.
19.下列微粒的半径比值大于1的是( )
| A. | Mg2+/Mg | B. | K+/S2- | C. | N/P | D. | Cl-/Cl |
6.如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )


| A. | 该元素的名称是铁 | B. | 该元素的原子序数为26 | ||
| C. | 该元素在地壳中的含量为55.85% | D. | 该元素的元素符号为Fe |
16.可逆反应A(g)+3B(g)═2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
| A. | VA=0.15mol/(L•min) | B. | VB=0.6mol/(L•min) | ||
| C. | VC=0.4mol/(L•min) | D. | VD=0.6mol/(L•min) |
3.下列叙述正确的是( )
| A. | P4和NO2都是共价化合物 | |
| B. | 次氯酸的结构式为H-Cl-O | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | CCl4和NH4Cl都是以共价键结合的分子 |
20.鉴别食盐水和蔗糖水的方法:
(1)向两种溶液中加入少量稀硫酸并加热,再加氢氧化钠溶液中和硫酸,最后加入银氨溶液微热;
(2)测溶液导电性;
(3)将溶液与溴水混合,振荡;
(4)用舌头尝味道.
其中在实验室进行鉴别的正确方法是( )
(1)向两种溶液中加入少量稀硫酸并加热,再加氢氧化钠溶液中和硫酸,最后加入银氨溶液微热;
(2)测溶液导电性;
(3)将溶液与溴水混合,振荡;
(4)用舌头尝味道.
其中在实验室进行鉴别的正确方法是( )
| A. | (1)(2) | B. | (1)(3) | C. | (2)(3) | D. | (1)(2)(3)(4) |
 从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下: