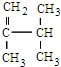题目内容
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: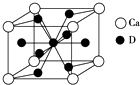
(1)A、B、C的第一电离能由小到大的顺序是(用对应的元素符号表示);基态D原子的电子排布式为 .
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取杂化;BC ![]() 的空间构型为(用文字描述).
的空间构型为(用文字描述).
(3)1molAB﹣中含有的π键数目为 .
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 .
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn , 它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10﹣23 cm3 , 储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=(填数值);氢在合金中的密度为
【答案】
(1)C<O<N;1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)SP2;平面三角形
(3)2NA
(4)1:5
(5)5;0.083g?cm﹣3
【解析】解:A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A为C原子; C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构且核电荷数介于A与C之间,因此B为N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D为Cu元素.(1)同一周期,从左往右,随着核电荷数的增大,第一电离能不断增大,但ⅡA族、ⅤA族的第一电离能大于其相邻元素,因此C、N、O第一电离能由小到大的顺序是<O<N;D原子为29号Cu原子,因此基态D原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1 , 所以答案是:C<O<N;1s22s22p63s23p63d104s1或[Ar]3d104s1;(2)A的最高价氧化物对应的水化物是H2CO3 , 该分子的中心原子C原子的价层电子对个数是3,且不含有孤对电子,因此采取的是SP2杂化;BC ![]() 为NO3﹣ , 空间构型为平面三角形;所以答案是:SP2;平面三角形;(3)由于CN﹣与N2互为等电子体,1mol N2中含有2molπ键,则1mol CN﹣中含有的π键数目为2NA; 所以答案是:2NA;(4)根据合金的晶胞结构示意图,该晶胞中Ca原子个数为
为NO3﹣ , 空间构型为平面三角形;所以答案是:SP2;平面三角形;(3)由于CN﹣与N2互为等电子体,1mol N2中含有2molπ键,则1mol CN﹣中含有的π键数目为2NA; 所以答案是:2NA;(4)根据合金的晶胞结构示意图,该晶胞中Ca原子个数为 ![]() ,Cu原子个数为
,Cu原子个数为 ![]() ,则Ca和Cu原子的个数比为1:5;所以答案是:1:5;(5)Ca、Cu合金化学式为CaCu5 , 由于镧镍合金与上述合金都具有相同类型的晶胞结构XYn , 所以该镧镍合金中的n=5;氢在合金中的密度为:
,则Ca和Cu原子的个数比为1:5;所以答案是:1:5;(5)Ca、Cu合金化学式为CaCu5 , 由于镧镍合金与上述合金都具有相同类型的晶胞结构XYn , 所以该镧镍合金中的n=5;氢在合金中的密度为: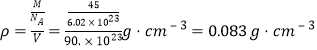 .所以答案是:5;0.083 gcm﹣3 .
.所以答案是:5;0.083 gcm﹣3 .

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
元素 | T | X | Y | Z |
性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;X形成的单质分子,含个σ键,个π键.写出Z元素原子的外围电子排布式;元素Y的原子核外共有种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式: .
(3)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g);△H=﹣92.4KJmol﹣1 . 现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图. 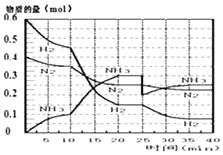
回答下列问题:
(1)10min内以NH3表示的平均反应速率;
(2)在10~20min内:NH3浓度变化的原因可能是;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为: , 第1次平衡:平衡常数K1=(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)2NH3(g)+ ![]() O2(g);△H=a kJmol﹣1
O2(g);△H=a kJmol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a0;△S0,(填“>”、“<”或“=”).